Experimento: Garrafa Azul
O experimento “a garrafa azul” explora reações de oxidação e redução envolvendo as substâncias glicose e azul de metileno.
Por Diogo Lopes Dias

PUBLICIDADE
O experimento que propomos aqui consiste no preparo de uma solução por meio de algumas substâncias no interior de uma garrafa PET. Esse processo é interessantíssimo para que o estudante possa compreender alguns assuntos importantes da Química, como:
-
Deslocamento de equilíbrio químico;
-
Solubilidade de substâncias em água;
-
Fenômenos exotérmicos (liberação de energia na forma de calor);
-
Catalisadores (substâncias que favorecem o aumento da velocidade de uma reação);
-
Redução e oxidação em compostos orgânicos.
Materiais necessários
-
600 mL de água;
-
5 mL de azul de metileno (indicador encontrado em lojas de reagentes químicos e produtos para laboratório ou em farmácias);
-
18 gramas de dextrose ou glicose (encontrada em loja de suplementos para atletas);
-
10 gramas de hidróxido de sódio puro (encontrado em lojas de reagentes químicos e produtos para laboratório) ou soda cáustica (encontrada em supermercados);
-
1 garrafa PET de 1,5 L a 2 L de capacidade;
-
Luvas descartáveis;
-
Jaleco de manga comprida;
-
Óculos de proteção;
-
Máscara de proteção.
Procedimento
-
1º Passo: Adicionar toda a água ao interior da garrafa;
-
2º Passo: Adicionar todo o hidróxido de sódio à garrafa com água. Fechar muito bem a garrafa. Em seguida, agitar bem para que todo o hidróxido seja dissolvido (esse passo requer muita atenção, pois a mistura terá elevação de temperatura);
-
3º Passo: Adicionar toda a glicose ao interior da garrafa e fechá-la bem. Em seguida, agitar para que toda a glicose seja dissolvida;
-
4º Passo: Adicionar todo o azul de metileno no interior na garrafa, fechar bem e agitar vigorosamente por cinco segundos (Nesse passo, toda a solução ficará azul);
-
5º Passo: Deixar a garrafa em repouso (Nesse passo, toda a solução ficará incolor).
Discussão dos resultados
→ 1ª Discussão:
Inicialmente, antes da adição do azul de metileno, temos na solução a presença de ácidos carboxílicos e sais de ácidos carboxílicos. Eles são produzidos porque:
-
Quando a glicose está em meio básico, seu grupo carbonila é convertido em um grupo carboxila. Isso ocorre por intermédio do oxigênio presente no ar.
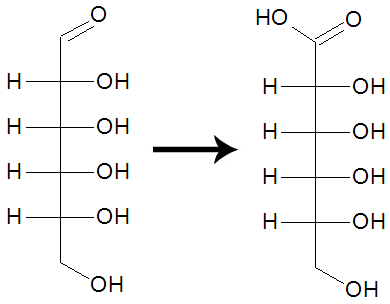
Equação da oxidação da molécula de glicose em meio ácido
-
O ácido carboxílico formado tem a tendência de interagir com o hidróxido de sódio e formar um sal de ácido carboxílico.
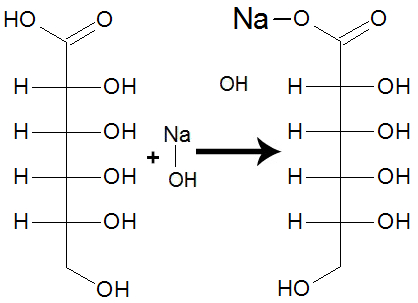
Equação de formação do sal de ácido carboxílico
→ 2ª Discussão:
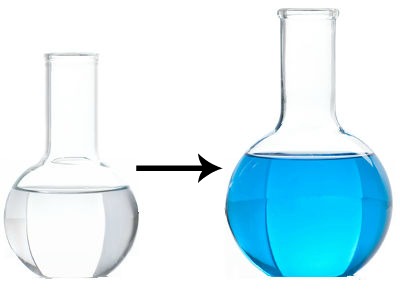
Resultado final do experimento da garrafa azul
Após a adição do azul de metileno (4o passo), agitação e repouso (5o passo), observa-se que, com a agitação, a solução fica azul, mas, em repouso, volta a ser incolor.
Essa mudança de cor acontece porque, na ausência de gás oxigênio, o azul de metileno é reduzido a leucometileno. Quando agitamos a garrafa, fazemos com que o oxigênio seja dissolvido na água, formando ácidos e sais de ácidos carboxílicos.
Na presença de oxigênio, o leucometileno converte-se em azul de metileno. Quando a concentração de O2 zera porque o azul de metileno forneceu todo o oxigênio à glicose, temos a transformação do azul de metileno novamente em leucometileno.
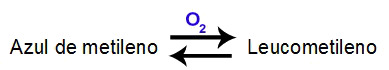
Equilíbrio químico presente no experimento “a garrafa azul”
Relação do experimento com conteúdos químicos
Durante a realização do experimento, podemos visualizar na prática vários conceitos químicos:
a) Solubilidade em água:
A solubilidade de uma substância em água depende de diversos fatores, como composição química e o tipo de força intermolecular que a molécula realiza.
-
O hidróxido de sódio é solúvel em água porque é uma base inorgânica (formada por um metal e uma hidroxila);
-
A glicose é bastante solúvel em água por apresentar hidroxilas, que interagem com as moléculas de água por meio de ligações de hidrogênio.
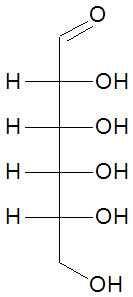
Fórmula estrutural da glicose
Quando o hidróxido de sódio dissolve-se em água, ele libera uma certa quantidade de calor.
Os catalisados diminuem a energia de ativação de um processo químico, aumentando a velocidade da reação. No experimento foram utilizados dois catalisadores:
-
Hidróxido de sódio
-
Azul de metileno
Se não utilizarmos essas substâncias, não haverá alteração de cor no experimento.
d) Deslocamento de equilíbrio químico
Quando um sistema em equilíbrio é perturbado (recebe uma quantidade maior de uma substância ou sofre ação da pressão e temperatura), ele busca, logo em seguida, voltar a situação de equilíbrio.
No experimento, perturbamos o equilíbrio quando realizamos a agitação da garrafa, favorecendo um aumento da concentração de oxigênio dissolvido na água.
e) Redução e oxidação de compostos orgânicos
Durante o experimento, a molécula de glicose recebeu oxigênio, o que resultou na transformação do grupo carbonila em um grupo carboxila, caracterizando uma reação de oxidação. Já a reação de redução ocorreu entre o azul de metileno e o leucometileno.
Por Me. Diogo Lopes Dias










