Experimento de química sobre complexos de cobre
Este experimento de química sobre complexos de cobre aborda as condições para a construção de macromoléculas a partir da interação de átomo de cobre com outros grupos.
Por Diogo Lopes Dias

PUBLICIDADE
O experimento de química sobre complexos de cobre é uma alternativa de aprendizado, a qual pode ser utilizada para facilitar a compreensão da construção de compostos denominados complexos de cobre.
Os complexos de cobre são macromoléculas (moléculas grandes) nas quais um átomo de cobre interage com vários átomos, íons ou moléculas. Neste experimento de química sobre formação de complexos de cobre, o átomo de cobre formará complexos com os seguintes materiais:
-
Amônia
-
Glutamato
-
Cloro
-
Uréia
Além da formação de complexos químicos, o experimento de química sobre complexos de cobre é interessante para realizarmos o estudo, além dos complexos químicos, dos seguintes aspectos dentro da química:
-
Preparo de soluções,
-
Dissociação de sais,
-
Identificação de ocorrência de reação química
-
Fenômenos exotérmicos.
1- Materiais e reagentes
Os materiais e reagentes que devemos ter para realizar o experimento de química sobre complexos de cobre são:
-
1 béquer de 150 mL
-
5 béqueres de 50 mL
-
1 pipeta
-
1 pera de sucção
-
1 conta gotas
-
6 baquetas
-
Água
-
30 mL de vinagre
-
50 mL de ácido clorídrico
-
2 g de bicarbonato de amônio
-
2 g de uréia
-
2 g de hidróxido de sódio
2- Procedimentos
Para a realização do experimento sobre complexos de cobre, são necessárias as realizações dos seguintes passos:
a) Para o preparo da solução de cobre
Passo 1: Pesar cerca de 10 gramas de sulfato de cobre na balança
Passo 2: Medir 100 mL de água em um béquer
Passo 3: Adicionar todo o sulfato de cobre no béquer contendo água. Agitar bastante para dissolver bem o sal. Esta solução será chamada de solução de cobre.

Representação do resultado final do preparo de uma solução aquosa de sulfato de cobre
b) Para a complexação de cobre com amônia (NH3)
Passo 1: Pesar 1 g de bicarbonato de amônio (NH4HCO3) na balança,
Passo 2: Medir 30 mL de água em um béquer,
Passo 3: Adicionar todo o bicarbonato de amônio na água. Em seguida agitar bem até dissolvê-lo.
Passo 4: Acrescentar 2,5 mL da solução de cobre no béquer contendo a mistura bicarbonato e água.
Passo 5: Gotejar ácido clorídrico até que haja uma mudança de coloração.

Representação do resultado final do preparo de uma solução de cobre e bicarbonato
c) Para a complexação do cobre com o glutamato
Passo 1: Pesar 1 g de Aji-no-moto na balança,
Passo 2: Medir 20 mL de água em um béquer,
Passo 3: adicionar todo o Aji-no-moto na água. Em seguida agitar bem até dissolvê-lo.
Passo 4: Acrescentar 2,5 mL da solução de cobre no béquer contendo a mistura Aji-no-moto e água.

Representação do resultado final do preparo de uma solução de ácido e Aji-no-moto
d) Para a formação do complexo cobre e cloro
Passo 1: Medir 2,5 mL da solução de sulfato de cobre em um béquer,
Passo 2: Medir 10 mL de água em um béquer, e em seguida transferi-lo
Passo 3: Gotejar ácido clorídrico até que haja uma mudança de cor permanente da solução.

Representação do resultado final do preparo de uma solução de cobre e cloro
e) Preparação da solução de hidróxido de sódio
Passo 1: Medir 30 mL de água em um béquer,
Passo 2: Pesar 2 gramas de hidróxido de sódio (NaOH),
Passo 3: Adicionar o hidróxido de sódio no béquer com água, e agitar até dissolvê-lo.

Representação do resultado final do preparo de uma solução aquosa de hidróxido
f) Para a preparação do complexo de cobre e uréia
Passo 1: Pesar 2 gramas de uréia,
Passo 2: Medir 20 mL de água em um béquer,
Passo 3: Adicionar toda a uréia no béquer com água, e agitar até dissolvê-lo,
Passo 4: Adicionar 3 gotas da solução de cobre no béquer.

Representação do resultado final do preparo de uma solução de cobre e uréia
3- Explicação dos resultados alcançados em cada procedimento
De uma forma geral, a verificação e comprovação da formação dos complexos de cobre, neste experimento sobre complexos, é feita através da modificação da coloração das soluções preparadas, em comparação com a solução de cobre preparada inicialmente.
a) Na letra a do procedimento temos a ocorrência da dissociação do sulfato de cobre ao dissociar em água.
CuSO4 → Cu+2 + SO4-2
b) Na letra b, quando o bicarbonato de amônio é dissolvido em água, sofre decomposição, formando o gás amônia (NH3), grupo este que irá interagir com o cobre formando o complexo.
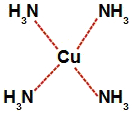
Representação da estrutura do complexo de cobre e amônia
c) Na letra c do procedimento, o glutamato monossódico (Aji-no-moto) ao ser dissolvido em água, dissocia, liberando o cátion sódio e o ânion glutamato. Este ânion glutamato é quem vai interagir com o átomo de cobre apara a formação do complexo de cobre e glutamato.
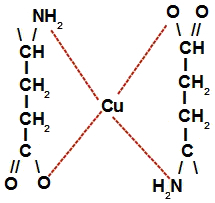
Representação da estrutura do complexo de cobre e glutamato
d) Na letra d, quando o ácido clorídrico é misturado com a água, ele ioniza, formando cátions hidrônio ânions cloreto (Cl-). Os ânions cloreto interagem com o átomo de cobre, formando o complexo de cobre e cloro.
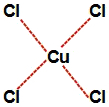
Representação da estrutura do complexo de cobre e cloro
e) Na letra e temos a dissociação do hidróxido de sódio em água, fenômeno este que libera calor.
NaOH + H2O → Na+ + OH-
f) Na letra f, quando o sulfato de cobre é misturado com a solução catalisada de uréia, temos a interação de moléculas da uréia com o átomo de cobre, formando o complexo de cobre e uréia.
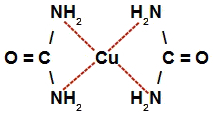
Representação da estrutura do complexo de cobre e uréia
Durante a realização do experimento de química sobre complexos de cobre, a formação dos complexos é identificada apenas través da modificação da coloração da solução final, em comparação com a solução de cobre realizada no procedimento a.
Por Me. Diogo Lopes Dias