Teste de chama
O teste de chama é um método qualitativo rápido e visual que permite a identificação preliminar dos elementos metálicos presentes em uma amostra.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
O teste de chama é uma técnica de análise qualitativa, isto é, que apenas determina a presença de uma espécie química, mas não a quantifica. Em vista disso, esse teste é bastante utilizado em laboratórios de Química para a análise preliminar, devido à sua agilidade e simplicidade em fornecer informações rápidas e visuais sobre a composição de amostras. No entanto, ele não é totalmente específico, pois diferentes metais podem produzir cores semelhantes, e a presença de várias substâncias pode interferir no resultado.
Leia também: Quais são as vidrarias de um laboratório de Química?
Resumo sobre o teste de chama
- O teste de chama é um método qualitativo usado para identificar a presença de certos metais em uma amostra.
- Funciona ao excitar elétrons dos átomos metálicos com o calor da chama, fazendo com que emitam luz ao retornar ao estado fundamental.
- A cor da chama emitida é específica para cada elemento, permitindo sua identificação.
- Exemplos de cores observadas incluem amarelo para sódio, lilás para potássio, verde para cobre e vermelho para lítio.
- É amplamente utilizado em laboratórios de Química para análise preliminar de amostras e em contextos educacionais para demonstrar conceitos de espectroscopia.
- O teste é rápido e simples, mas pode ser limitado pela presença de múltiplos metais que podem interferir na cor observada.
O que é o teste de chama?
O teste de chama é uma técnica analítica qualitativa usada para identificar a presença de certos metais em uma amostra que é exposta diretamente a uma chama, onde cada metal emite uma cor específica que permite identificá-lo.
Para que serve o teste de chama?
O teste de chama serve principalmente para a identificação preliminar de metais em uma amostra, ou seja, ele é utilizado para determinar rapidamente quais elementos estão presentes com base na cor da chama emitida quando a amostra é aquecida. Nesse sentido, ele é útil em várias áreas da Química, como:
- Análise qualitativa: em laboratórios, o teste de chama é uma técnica simples para identificar cátions metálicos em amostras desconhecidas.
- Controle de qualidade: indústrias que lidam com sais metálicos ou compostos inorgânicos podem usá-lo para verificar a pureza ou composição de seus produtos.
- Ensino de Química: em ambientes educacionais, ele é frequentemente utilizado como uma ferramenta didática para demonstrar conceitos de espectroscopia e a natureza quântica da luz emitida por átomos excitados.
- Pesquisa científica: em estudos químicos, o teste pode ser usado como um método rápido de triagem para a identificação de metais antes de métodos analíticos mais sofisticados.
Fundamento teórico do teste de chama
O fundamento teórico do teste de chama baseia-se na excitação dos elétrons dos átomos de metais presentes na amostra. Tal perspectiva é oriunda do modelo atômico de Bohr, que sugere que os elétrons orbitam o núcleo em níveis de energia discretos. Logo, quando um átomo absorve energia, como o calor de uma chama, seus elétrons podem ser excitados para níveis de energia mais altos em um processo conhecido como “salto quântico”. Em contrapartida, quando esses elétrons retornam ao seu estado fundamental, eles emitem a energia absorvida na forma de luz visível com comprimentos de onda específicos, que correspondem às cores observadas no teste de chama. Diante disso, veja a seguir uma ilustração do salto de elétron:
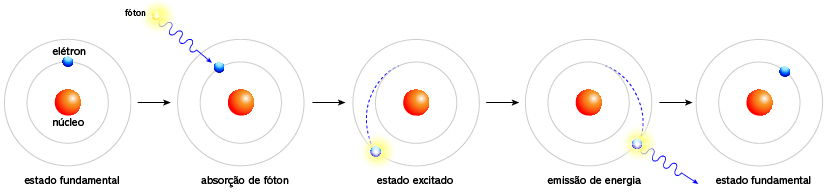
Por que o fogo muda de cor no teste de chama?
Primeiramente é preciso entender que a cor emitida no teste de chama depende da diferença de energia entre os níveis envolvidos, sendo característica para cada elemento. Por exemplo, quando a amostra é aquecida na chama, o fogo muda de cor devido à excitação dos elétrons dos átomos metálicos presentes na amostra. Logo, a cor emitida pela chama é determinada pelo comprimento de onda da luz liberada, que é específico para cada elemento químico. Ou seja, cada tipo de átomo tem um conjunto único de níveis de energia, o que significa que os saltos de energia (e, portanto, os comprimentos de onda da luz emitida) também são únicos.
Por exemplo, o sódio emite luz na faixa do amarelo, enquanto o cobre emite na faixa do verde. Essa emissão de luz com comprimentos de onda específicos, e consequentemente com cores distintas, é o que causa a mudança de cor na chama durante o teste. Portanto, a cor observada reflete a identidade dos elementos presentes na amostra.
Como é feito o teste de chama?
O teste de chama é realizado seguindo um procedimento simples, mas que exige atenção para garantir resultados precisos. Nesse sentido, ele segue basicamente as seguintes etapas:
- Preparação da amostra: a amostra a ser testada deve estar na forma de um sal ou composto contendo o metal de interesse. Se a amostra estiver em estado sólido, ela pode ser dissolvida em um pequeno volume de água destilada para facilitar a aplicação.
- Preparação do instrumento: usa-se uma alça de platina, ou fio de nicromo (uma liga de níquel e cromo), que deve ser limpa cuidadosamente antes de cada teste para evitar contaminação. Isso geralmente é feito mergulhando a alça em ácido clorídrico concentrado e, em seguida, queimando-a na chama até que não emita mais cor.
- Aplicação da amostra: após a limpeza, a alça é mergulhada na solução da amostra ou tocada na amostra sólida para que uma pequena quantidade do composto adira a ela.
- Exposição à chama: a alça com a amostra é então colocada na chama de um bico de Bunsen ou similar.
Importante: É importante usar uma chama azul (rica em oxigênio) para evitar interferências na cor emitida.

- Observação da cor: observa-se a cor da chama que aparece ao redor da amostra. Lembre-se de que cada metal emite uma cor específica.
- Interpretação dos resultados: a cor observada é comparada com um padrão de referência para identificar os metais presentes na amostra. Se houver mais de um metal, a cor predominante pode indicar a presença de um elemento específico, entretanto a presença de múltiplos elementos pode complicar a interpretação.
Importante: Para garantir precisão, o teste pode ser repetido várias vezes, especialmente se houver suspeita de contaminação ou se a amostra for complexa.
Quais cores são observadas no teste de chama?

No que tange às cores, algumas das mais comuns observadas para diferentes elementos metálicos são:
- Sódio (Na): amarelo intenso.
- Potássio (K): lilás ou violeta.
- Cálcio (Ca): laranja-avermelhado.
- Estrôncio (Sr): vermelho intenso.
- Lítio (Li): vermelho-carmim.
- Cobre (Cu): verde-esmeralda ou azul-esverdeado.
- Bário (Ba): verde-amarelado.
- Césio (Cs): azul-claro.
- Rubídio (Rb): vermelho-púrpura.
- Boro (B): verde brilhante.
Substâncias testadas no teste de chama
No teste de chama, as substâncias mais frequentemente testadas são sais metálicos, porque ao serem excitados pela chama emitem cores características, e isso ocorre justamente por causa da presença dos metais, que são os objetos de interesse para esse tipo de análise. Sendo assim, veja no quadro abaixo alguns dos compostos mais comuns e os elementos testados:
|
Substância |
Elemento testado |
Cor da chama emitida |
|
Cloreto de sódio (NaCl) |
Sódio |
Amarelo intenso |
|
Cloreto de potássio (KCl) |
Potássio |
Lilás ou violeta |
|
Cloreto de cálcio (CaCl2) |
Cálcio |
Laranja-avermelhado |
|
Cloreto de estrôncio (SrCl2) |
Estrôncio |
Vermelho intenso |
|
Cloreto de lítio (LiCl) |
Lítio |
Vermelho-carmim |
|
Sulfato de cobre (CuSO4) |
Cobre |
Verde-esmeralda ou azul-esverdeado |
|
Cloreto de bário (BaCl2) |
Bário |
Verde-amarelado |
|
Cloreto de césio (CsCl) |
Césio |
Azul-claro |
|
Cloreto de rubídio (RbCl) |
Rubídio |
Vermelho-púrpura |
|
Ácido bórico (H3BO3) |
Boro |
Verde brilhante |
Essas substâncias são escolhidas porque os seus íons metálicos são facilmente excitados pela chama, resultando em cores distintas que permitem a identificação qualitativa dos elementos presentes.
Veja também: O que é o experimento químico “arco-íris de licopeno”?
Exercícios resolvidos sobre teste de chamas
Questão 1
(Uece) O livro Curiosidades da Ciência, da Editora Abril, traz uma matéria intitulada “Por que o fogo pode ter várias cores diferentes?”. Uma experiência conhecida como teste da chama, que utiliza sais de alguns metais aquecidos pelo bico de Bunsen, responde à indagação. Sobre o teste da chama, é INCORRETO afirmar que
A) ilustra, de maneira simples e convincente, o salto quântico.
B) está baseado no espectro de emissão característico de cada elemento.
C) pode ser usado na identificação de alguns íons metálicos.
D) a presença de contaminantes na amostra do metal não impede a precisão do experimento.
Resolução:
Alternativa D.
Vamos analisar cada caso:
A) CERTO – O teste de chama é um exemplo prático do “salto” dos elétrons que partem de níveis eletrônicos de menor energia para níveis de maior energia, bem como o processo inverso, com a liberação de energia em forma de luz.
B) CERTO – Cada elemento emite luz em um comprimento de onda específico, conhecido como espectro de emissão.
C) CERTO – Íons metálicos presentes em soluções aquosas ou sólidas podem ser identificados nesse teste.
D) ERRADO – A presença de contaminantes na amostra do metal é justamente uma das limitações desse método, pois a presença deles, sobretudo outros metais, pode emitir uma coloração diferente da esperada, interferindo na precisão do experimento.
Questão 2
(UEMG) O teste de chama é uma técnica utilizada para identificar átomos ou cátions presentes em substâncias ou misturas. Por exemplo, quando uma pequena quantidade de cloreto de sódio é levada à chama de um bico de Bunsen, observa-se que a chama inicialmente azul adquire uma coloração laranja. Assim, na queima de fogos de artifício, verificamos várias cores devido aos diferentes sais utilizados na fabricação dos fogos.
Essas cores podem ser explicadas pelo modelo atômico de
A) Bohr.
B) Dalton.
C) Rutherford.
D) Thomson
Resolução:
Alternativa A.
O modelo atômico de Bohr compreende os elétrons em órbitas definidas (quantizadas) que, ao serem excitados, saltam de uma camada para outra mais externa e retornam liberando a energia absorvida na forma de luz, cujo comprimento de onda, e consequentemente a cor, varia para cada elemento.
Fontes
BARROW, R F; CALDIN, E F. Some Spectroscopic Observations on Pyrotechnic Flames. Proceedings of the Physical Society. Section B, [s. l.], v. 62, n. 1, p. 32–39, 1949. Disponível em: https://iopscience.iop.org/article/10.1088/0370-1301/62/1/305.
GRACETTO, Augusto César; HIOKA, Noboru; FILHO, Ourides Santin. Combustão, chamas e teste de chama para cátion. Química Nova na Escola, [s. l.], v. 23, p. 43–48, 2006.
LANDIS, Arthur M. et al. “Magic Eraser” Flame Tests. Journal of Chemical Education, [s. l.], v. 86, n. 5, p. 577, 2009.








