Físico-Química
A Físico-Química é um ramo interdisciplinar que une conceitos da Física e da Química para estudar as propriedades e transformações da matéria em nível molecular e atômico.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
A Físico-Química é um ramo interdisciplinar que se dedica ao estudo das propriedades físicas e químicas da matéria, bem como as leis que governam as transformações químicas. Além disso, uma de suas belezas reside na sua capacidade de aplicar princípios matemáticos e físicos para prever e explicar os comportamentos das substâncias. Isso é feito através de conceitos fundamentais como a termodinâmica, que estuda a energia e suas transformações; a cinética química, que analisa a velocidade das reações químicas; e a mecânica quântica, que explica a estrutura eletrônica dos átomos e moléculas.
Esses conceitos permitem aos cientistas não apenas entender, mas também manipular a matéria em níveis nunca antes imaginados, abrindo portas para inovações em áreas como a nanotecnologia, materiais, bioquímica, entre outras. Logo, a Físico-Química tem um papel crucial na resolução de problemas globais, desde o desenvolvimento de tecnologias mais eficientes para a produção de energia limpa até a criação de novos medicamentos.
Leia também: Afinal, o que é Química?
Resumo sobre Físico-Química
-
A Físico-Química é um ramo interdisciplinar que estuda os princípios físicos e químicos da matéria, bem como as relações entre energia, matéria e transformações químicas.
-
Combina conceitos da Física e da Química para explicar fenômenos em nível molecular e atômico.
-
Surgiu da fusão de ambas as disciplinas no final do século XIX e início do século XX.
-
Envolve áreas como termodinâmica, cinética química, equilíbrio químico, eletroquímica e química quântica.
-
É importante para o entendimento dos processos químicos e o desenvolvimento de novas tecnologias e materiais.
-
Ajuda a prever e controlar reações químicas em diversos processos industriais.
-
É fundamental para áreas como nanotecnologia, biologia molecular e ciência dos materiais.
O que é a Físico-Química?
A Físico-Química é uma parte da Química que estuda os princípios físicos e químicos que regem os processos e as transformações da matéria. Nesse sentido, ela se concentra em entender como a matéria se comporta em nível molecular e atômico, e como isso influencia as propriedades macroscópicas das substâncias.
O que se estuda na Físico-Química?
Como disciplina, no âmbito acadêmico, a Físico-Química combina conceitos da Física e da Química para explicar fenômenos como a formação de compostos, a mudança de fase da matéria e a energia envolvida em reações químicas, bem como a relação entre estrutura molecular e propriedades macroscópicas. Com base nisso, separamos logo abaixo os principais tópicos estudados nessa matéria, os quais são divididos, para fins didáticos, da seguinte forma:
|
Tópico |
Objeto de estudo |
|
Termodinâmica |
Relações entre calor, trabalho e energia em sistemas químicos, incluindo a previsão da espontaneidade das reações químicas. |
|
Velocidade das reações químicas e os fatores que a influenciam, como temperatura, concentração e catalisadores. |
|
|
Condições em que as reações químicas atingem um estado de equilíbrio e como essas condições podem alterar o equilíbrio. |
|
|
Relações entre reações químicas e correntes elétricas, como em pilhas eletroquímicas e eletrólise. |
|
|
As trocas de energia em forma de calor que acompanham as reações químicas. Envolve o cálculo de entalpia, energia interna, entropia e energia livre, sendo fundamental para entender se uma reação é exotérmica (libera calor) ou endotérmica (absorve calor), além de sua espontaneidade. |
|
|
Propriedades dos gases ideais e reais, incluindo leis como a lei de Boyle, a lei de Charles e a lei de Avogadro. Também aborda o comportamento dos gases em diferentes condições de temperatura e pressão, bem como sua aplicação em processos industriais e ambientais. |
|
|
Espectroscopia |
Interação entre matéria e radiação eletromagnética, permitindo a análise da composição química de substâncias e o estudo da estrutura molecular. |
|
Coloides e superfícies |
Propriedades de sistemas nos quais uma substância está dispersa de forma finamente dividida em outra, além de investigar fenômenos em interfaces. |
|
Catálise |
Processos pelos quais uma substância (catalisador) aumenta a velocidade de uma reação química sem ser consumida. |
Em síntese, a Físico-Química busca compreender as leis físicas que regem os processos químicos, fornecendo uma base teórica sólida para o estudo e desenvolvimento de novos materiais, processos químicos e tecnologias.
Como a Físico-Química cai no Enem?
No Enem, a Físico-Química geralmente aparece em questões que buscam avaliar o entendimento dos estudantes sobre os princípios fundamentais da matéria e suas transformações. Diante disso, listamos abaixo alguns tópicos e o que geralmente é cobrado em cada um deles:
-
Termodinâmica: conhecimento sobre as leis da termodinâmica e sua aplicação em situações práticas, como o cálculo de variação de energia em processos químicos.
-
Cinética química: questões nesse tema podem abordar a velocidade das reações químicas, os fatores que a influenciam e como isso se relaciona com a prática laboratorial.
-
Equilíbrio químico: o entendimento sobre o conceito de equilíbrio químico, como identificar se uma reação está ou não em equilíbrio e como mudanças nas condições a afetam.
-
Eletroquímica: pode abordar o funcionamento de pilhas eletroquímicas, a relação entre potenciais padrão e espontaneidade de reações eletroquímicas.
-
Gases: geralmente abordam as leis dos gases ideais e reais, podendo ou não envolver cálculos de volume, pressão, temperatura e quantidade de substância gasosa, além de compreender o comportamento dos gases em diferentes condições.
-
Termoquímica: é um tema recorrente, com questões que envolvem o cálculo de entalpia, energia interna, entropia e energia livre em reações químicas. Portanto, é necessário entender os conceitos de calor de reação, calor de formação, entalpia padrão de formação e suas aplicações em determinar a espontaneidade de uma reação e as condições termodinâmicas de equilíbrio.
Por fim, no que tange à Físico-Química, no Enem busca-se avaliar a compreensão dos estudantes sobre os princípios físicos e químicos que regem os processos químicos, bem como sua capacidade de aplicar esses conhecimentos em situações do cotidiano e em contextos científicos mais amplos.
Acesse também: Química Geral — detalhes sobre outra importante área da Química
História da Físico-Química
A história da Físico-Química é marcada por uma evolução gradual, em que a fusão dos princípios da Física e da Química deu origem a uma nova disciplina científica. Sendo assim, o seu desenvolvimento começou a se consolidar no final do século XIX e início do século XX, impulsionado por diversos cientistas que buscavam entender melhor os fenômenos químicos por meio de fundamentos físicos. Sendo assim, veja a seguir os principais eventos que proporcionaram o nascimento e desenvolvimento dessa área matéria:
-
Século XVIII: primeiro, tivemos como um marco importante a formulação da lei da conservação da massa por Antoine Lavoisier, no final do século XVIII, que estabeleceu uma base sólida para o desenvolvimento da Química como ciência. Posteriormente, os estudos sobre os gases, realizados por cientistas como Joseph Louis Gay-Lussac e Jacques Charles, contribuíram para o estabelecimento das leis dos gases ideais, que são fundamentais para a compreensão de fenômenos físico-químicos.
-
Século XIX: já no século XIX, o trabalho de Jöns Jacob Berzelius foi fundamental para o desenvolvimento da estequiometria e para a introdução do conceito de átomo na Química. Nesse contexto, Berzelius também foi um dos primeiros a sugerir a existência de ligações químicas entre os átomos, contribuindo para o surgimento da Química Estrutural. No final do século XIX, o físico e químico britânico Willard Gibbs desenvolveu os princípios fundamentais da termodinâmica química, estabelecendo as bases teóricas para a compreensão das reações químicas em termos de energia. Vale destacar que seu trabalho foi fundamental para o desenvolvimento da Físico-Química como disciplina.
-
Século XX: no século XX, a Físico-Química continuou a se desenvolver rapidamente, com avanços significativos em áreas como a cinética química, a espectroscopia e a química quântica. Nesse caso, a aplicação de técnicas físicas à Química permitiu avanços importantes no entendimento dos processos químicos em nível molecular e atômico, levando ao desenvolvimento de novos materiais e tecnologias. Um exemplo importante é a análise qualitativa de elementos, através de métodos espectroscópicos, os quais identificam substâncias pela interação da matéria com a energia eletromagnética, conforme demonstrado na imagem abaixo, em que há a identificação do sódio no teste de chama.

Por fim, atualmente a Físico-Química é uma disciplina essencial para a compreensão das reações químicas e para o desenvolvimento de novos materiais e tecnologias em diversas áreas, desde a medicina até a engenharia de materiais.
Exercícios resolvidos sobre Físico-Química
Questão 1
(Enem) O ciclo do cobre é um experimento didático em que o cobre metálico é utilizado como reagente de partida. Após uma sequência de reações (I, II, III, IV e V), o cobre retorna ao seu estado inicial ao final do ciclo.
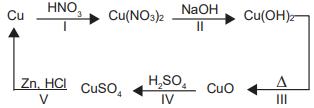
A reação de redução do cobre ocorre na etapa
A) I.
B) II.
C) III.
D) IV.
E) V.
Resolução:
Alternativa E.
Primeiro, lembre-se de que em reações de óxido-redução, na oxidação o Nox aumenta e na redução o Nox diminui. Além disso, é importante destacar que a questão pede a etapa em que ocorre a redução do cobre. Portanto, devemos verificar em qual delas o Nox é reduzido. Mas antes, vale lembrar que o Nox de toda substância simples ou monoatômica é igual a zero. Nesse caso, partiremos do cobre elementar (Cu), cujo Nox é zero. Vejamos cada uma delas:
I) Cu \(\Rightarrow \) Cu(NO3)2: Nox sai de 0 para +2 (oxidação)
II) Cu(NO3)2 \(\Rightarrow \) Cu(OH)2: Nox = +2
III) Cu(OH)2 \(\Rightarrow \) CuO: Nox = +2
IV) CuO \(\Rightarrow \) CuSO4: Nox = +2
V) CuSO4 \(\Rightarrow \) Cu: Nox sai de +2 para 0 (redução)
A etapa “V” é a única em que ocorre uma redução no Nox do cobre. Portanto, “E” é a nossa alternativa.
Questão 2
(Enem - PPL) Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento.
Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrões.
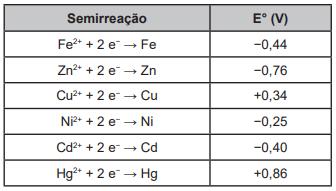
Dos metais citados, o que garantirá proteção ao tanque de aço é o:
A) zinco.
B) cobre.
C) níquel.
D) cádmio.
E) mercúrio.
Resolução:
Alternativa A.
Primeiro, perceba que a liga metálica contém ferro, metal facilmente oxidado. Segundo, a tabela fornecida apresenta o potencial padrão de redução (Eº) dos metais listados. Além disso, lembre-se de que quanto maior o potencial de redução, mais facilmente a substância será reduzida. Por outro lado, quanto menor o potencial de redução da espécie, mais fácil ocorre a sua oxidação.
Com base nisso, entenda que o metal de sacrifício, para o caso em tela, deverá ter um potencial de redução menor que o do ferro, cujo valor é: -0,44 V. Logo, o único que apresenta um valor abaixo do ferro é o zinco com -0,76 V. Ou seja, entre ele e o ferro, o zinco será oxidado primeiro, protegendo o ferro e consequentemente a estrutura do tanque de aço.
Fontes
FELTRE, Ricardo. Química: Físico-Química. 6. ed. São Paulo: Moderna, 2004. v. 2
L. BROWN, Theodore et al. Transformações físicas e químicas. In: QUÍMICA: A CIÊNCIA CENTRAL. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 1216.
REIS, Martha. Química. 1. ed. São Paulo: Editora Ática, 2013. v. 1