Corrosão e proteção de metais
Corrosão é o desgaste sofrido por uma peça metálica por causa de um processo eletroquímico. A proteção está ligada a métodos, como a eletrólise, para evitar que a corrosão ocorra.
Por Diogo Lopes Dias

PUBLICIDADE
A corrosão dos metais é um processo natural resultante, geralmente, de reações de oxirredução ou corrosão eletroquímica. Nesse processo, os metais sofrem desgastes por causa da ação de agentes naturais, como o gás oxigênio presente no ar.
Um exemplo de corrosão que ocorre no dia a dia é o processo de enferrujamento da palha de aço utilizada para lavar utensílios na cozinha. É comum observarmos que ela passa a apresentar uma cor avermelhada e se desfaça após um ou dois dias de uso.
Para evitar a corrosão dos metais, foram criados métodos de proteção.
Como ocorre a corrosão?
A corrosão é um processo de oxirredução, ou seja, um material (no caso, o metal) sofre oxidação (perde elétrons), e o outro, redução (ganha elétrons). Para sofrer oxidação, o metal deve apresentar um potencial de redução (Ered) menor que o material que entrou em contato com ele.
Se o zinco, que possui Ered = -0,76 V, entrar em contato com o ferro (Ered = -0,036 V), o ferro sofrerá oxidação, e o zinco sofrerá redução. Nesse caso, teríamos a corrosão do ferro. Veja as equações que representam os dois processos:
Oxidação: Fe → Fe+3 + 3e
Redução: Zn+2 + 2e → Zn
Assim, para saber qual material passará por oxidação ou redução, é necessário conhecer os potenciais de redução ou de oxidação de todos eles:
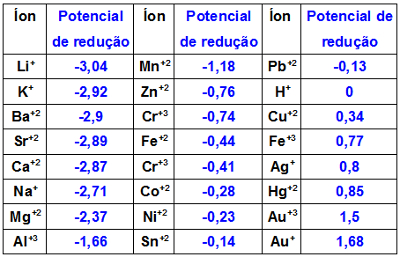
Potenciais de redução dos principais metais
Como ocorre a proteção do metal?
Para proteger um metal contra a corrosão, existem algumas técnicas úteis, a saber:
a) Pintura
Cobrir a superfície metálica com uma camada de tinta para evitar o contato do ar e da umidade com o metal. Esse tipo de procedimento é utilizado em carros, aviões, portões etc.
b) Plastificação
É o método de proteção de um metal no qual se utiliza um revestimento de polímero orgânico (plástico duro) para recobrir uma peça metálica. Esse tipo de procedimento é utilizado, por exemplo, em:
-
Tanques para armazenamento de água ou combustíveis;
-
Filtros de embarcações;
-
Válvulas para a condução de água potável.
c) Anodização
A anodização, também chamada de proteção por filme de óxido, é um processo de proteção de metais no qual um óxido (composto por átomos do próprio metal) é formado e recobre o metal, protegendo-o.
Um exemplo é a anodização do alumínio, na qual o metal alumínio é colocado em contato com uma solução aquosa de hidróxido de sódio (NaOH), produzindo o óxido de alumínio (Al2O3, alumina) e água. A alumina recobre a peça de alumínio, protegendo-a. Veja as reações que representam a anodização do alumínio:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2O
2NaAlO2 + 3H2O →Al(OH)3 + NaOH
Al(OH)3→ Al2O3 + 3H2O
d) Galvanoplastia
A galvanoplastia é uma técnica que consiste em cobrir uma peça de metal com outro metal diferente por meio do processo da eletrólise. Trata-se de uma técnica muito utilizada em:
-
Revestimento com estanho de latas de ferro;
-
Revestimento de chaves com níquel ou crômio;
-
Revestimento de um anel de latão com ouro;

Roda de carro que foi revestida com crômio
e) Proteção catódica
É um método de proteção de metais no qual um metal é colocado em contato com aquele que se deseja proteger. É uma técnica muito utilizada para a proteção de metais em:
-
Oleodutos (tubulação de grosso calibre);
-
Navios (revestimento do casco do navio);
-
Termoacumuladores (é um sistema de aquecimento da água, como o dos chuveiros elétricos).
Por Me. Diogo Lopes Dias