Estudo cinético da concentração dos reagentes
O estudo cinético da concentração dos reagentes aborda como a quantidade de moléculas dos reagentes pode influenciar a velocidade de uma reação.
Por Diogo Lopes Dias

PUBLICIDADE
A Cinética Química é o ramo da Físico-Química que estuda a ocorrência e os fatores que influenciam a velocidade de uma reação química. O estudo cinético está pautado em dois pilares importantes, que são: a energia de ativação (energia mínima para a ocorrência de uma reação) e a formação do complexo ativado (composto intermediário formado entre os reagentes e os produtos) nas reações.
Muitos são os fatores que podem influenciar a ocorrência de uma reação química, como a temperatura, os catalisadores, a pressão, a natureza dos reagentes, a eletricidade, a superfície de contato, a luz e a concentração. Neste texto vamos dar ênfase ao estudo cinético que se volta para a concentração dos reagentes.
Para que ocorra a formação do complexo ativado, é necessário que as ligações químicas entre as moléculas dos reagentes sejam rompidas para que eles possam interagir entre si. Mas para que isso ocorra, é necessário que os reagentes entrem em contato e choquem-se uns com os outros. A seguir temos uma representação da formação de um complexo ativado:
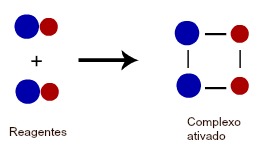
Representação da formação do complexo ativado entre duas moléculas
Como a formação do complexo ativado depende do contato entre os reagentes, quanto for maior a quantidade (concentração) de moléculas no meio reacional, maior será a probabilidade de choque entre essas moléculas e, consequentemente, mais rápida será a formação do complexo ativado. Assim, o estudo cinético da concentração dos reagentes mostra que o número de moléculas em uma reação deve ser grande para que elas tenham a condição de chocar-se um número maior de vezes, o que faria a reação processar-se com uma velocidade maior. Veja o esquema a seguir:
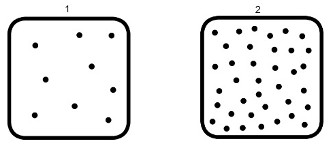
Representação de dois recipientes que apresentam um número de moléculas menor e maior, respectivamente
No exemplo acima, o recipiente 1 apresenta um menor número de moléculas, enquanto o recipiente 2 possui um número de moléculas muito maior. Por essa razão, é perceptível que as moléculas no recipiente 2 têm uma probabilidade de choques muito maior se comparadas com as moléculas no recipiente 1.
Segundo o estudo cinético da concentração dos reagentes, quanto mais as moléculas se chocam, maior é a probabilidade de formação do complexo ativado, maior é a formação dos produtos e maior é a velocidade da reação.

Por Me. Diogo Lopes Dias