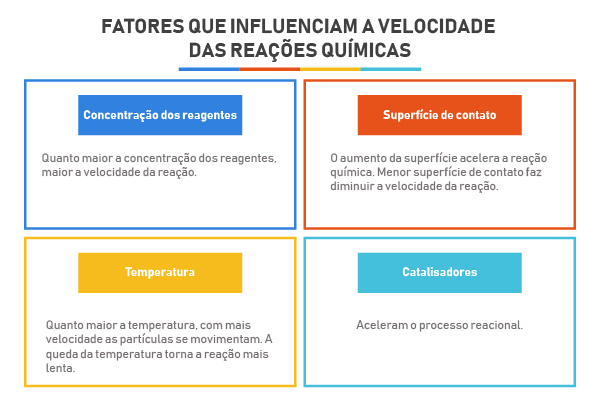
Estudo gráfico da velocidade das reações
O estudo gráfico da velocidade das reações fornece parâmetros para que seja possível avaliar a rapidez de uma determinada reação em comparação com outra.
Por Diogo Lopes Dias
PUBLICIDADE
Estudar a velocidade de uma reação é um atributo importante e interessante dentro da Química pelo fato de permitir a identificação de reações químicas rápidas ou lentas e ainda criar métodos para que reações lentas possam tornar-se mais rápidas e vice-versa. O ramo da Química que desenvolve esse estudo é denominado de Cinética Química.
Uma forma de estudar a velocidade das reações pode ser por análises gráficas. Basicamente, o gráfico cinético de uma reação apresenta no eixo x o termo caminho da reação e, no eixo y, o termo energia, como o modelo a seguir:
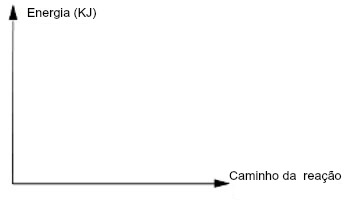
O gráfico da velocidade de reações aborda a energia e o caminho da reação
Nos gráficos, os reagentes (R) e os produtos (P) são representados em pequenas linhas horizontais. Os reagentes estão sempre posicionados próximos ao eixo y e os produtos, mais distantes do eixo y. Observe o modelo:
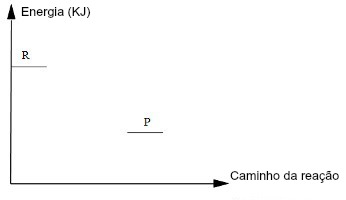
No estudo gráfico da velocidade das reações, os reagentes partem do eixo y e os produtos estão mais afastados desse eixo
Ligando as linhas horizontais de reagentes e produtos, temos uma curva, que inicia nos reagentes, sobe e desce até os produtos. O ponto máximo dessa curva indica a energia do complexo ativado (c.a.), e o trajeto dos reagentes até o complexo ativado indica a energia necessária para a formação desse complexo, que é chamada de energia de ativação (Eat.). No gráfico a seguir, temos uma seta azul que indica a energia de ativação da reação, bem como a indicação do complexo ativado no ponto mais alto da curva.
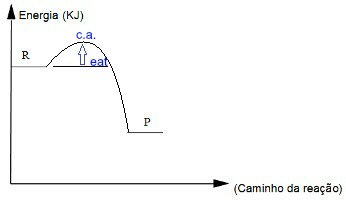
Gráfico que apresenta a energia de ativação e o complexo ativado de uma reação química
Quando a energia de ativação em um gráfico é pequena, temos que o complexo ativado foi formado mais rapidamente, o que indica que se trata de uma reação mais rápida. Já se a energia de ativação é muito grande, a formação do complexo ativado é mais demorada, o que indica que a reação é mais lenta. Comparando os dois gráficos a seguir, podemos visualizar que o gráfico A tem maior energia de ativação que o gráfico B; logo, A representa uma reação mais lenta.
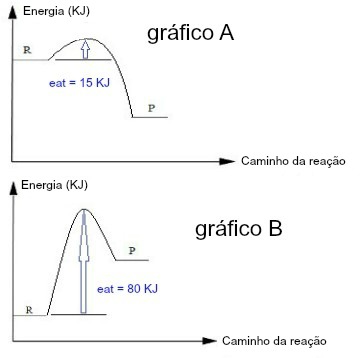
O gráfico A tem uma energia de ativação menor do que o gráfico B, logo indica uma reação mais lenta
Quando uma reação química processa-se com a utilização de um catalisador, podemos representar graficamente esse detalhe. A leitura da presença de um catalisador se dá por uma segunda curva abaixo da curva maior, indicando que a energia de ativação sofreu uma diminuição (c) que atingiu a formação do complexo ativado mais rapidamente, o que tornou a reação mais rápida.
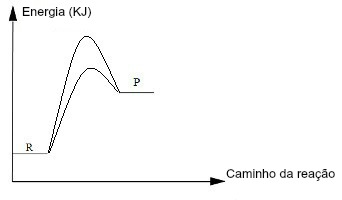
A curva mais baixa indica a presença de um catalisador
Realizando um estudo gráfico da velocidade de uma reação com catalisador, podemos observar que a seta azul indica uma energia de ativação menor, enquanto a seta vermelha indica uma energia de ativação maior. Por essa razão, a curva com a presença da seta azul indica uma reação com presença de catalisador, ou seja, que se processa de forma mais rápida.
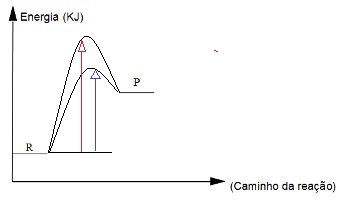
A curva com a seta vermelha indica uma reação ocorrendo com maior velocidade por ter uma energia de ativação menor graças à presença do catalisador
Por Me. Diogo Lopes Dias
Videoaula relacionada: