Fatores que influenciam a velocidade das reações químicas
Alguns fatores influenciam a velocidade das reações químicas, como a concentração dos reagentes, a superfície de contato, a temperatura e os catalisadores.
Por Stéfano Araújo Novais
PUBLICIDADE
Os fatores que influenciam a velocidade das reações químicas são condições reacionais que buscam alterar a velocidade com que um processo químico se desencadeia. A alteração desses fatores pode não só acelerar mas também diminuir a velocidade da reação química. Entre os fatores que influenciam a velocidade das reações químicas estão a concentração dos reagentes, a superfície de contato, a temperatura e os catalisadores.
Os fatores que influenciam a velocidade das reações químicas são conhecidos por conta das condições necessárias para se desencadear um processo químico, a chamada teoria das colisões, uma avaliação qualitativa das condições necessárias para que uma reação química se desencadeie.
Leia também: Estequiometria — estudo das relações quantitativas entre produtos e reagentes de uma reação
Resumo sobre fatores que influenciam a velocidade das reações químicas
- Os fatores que influenciam a velocidade das reações químicas são:
- a concentração dos reagentes;
- a superfície de contato;
- a temperatura;
- os catalisadores.
- Esses fatores são alterações nas condições do processo reacional que objetivam alterar a velocidade em que a reação se propaga, acelerando-a ou não.
- Tais fatores são embasados pela teoria das colisões, a qual apresenta, qualitativamente, as condições necessárias para que um processo químico ocorra.
- Basicamente uma reação química exige que os reagentes tenham afinidade, colidam entre si em uma geometria favorável e tenham uma energia cinética mínima nessa colisão, suficiente para romper as ligações químicas dos reagentes.
Videoaula sobre fatores que influenciam a velocidade das reações químicas
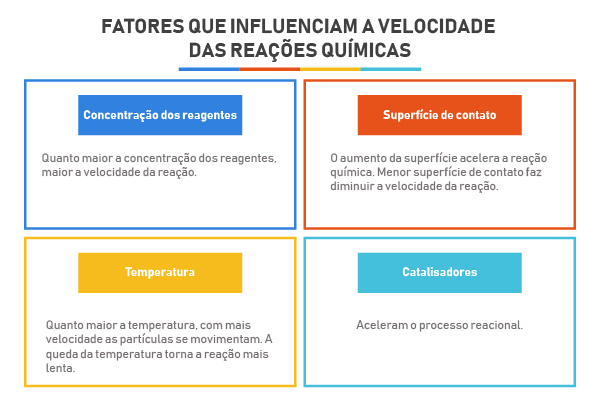
Quais são os fatores que influenciam a velocidade das reações químicas?
Entre os fatores que influenciam a velocidade das reações químicas estão:
- a concentração dos reagentes;
- a superfície de contato;
- a temperatura;
- os catalisadores.
→ Concentração dos reagentes
A teoria das colisões é clara quando diz que, para haver uma reação química, é necessária uma colisão efetiva: uma colisão entre as partículas do reagente, com orientação adequada e energia suficiente. Portanto, nem toda colisão resulta em reação química, apenas as consideradas efetivas.
Conforme há um aumento na concentração dos reagentes, maior o número de colisões por intervalo de tempo entre as partículas dos reagentes, ocasionando em uma maior probabilidade de colisão efetiva.
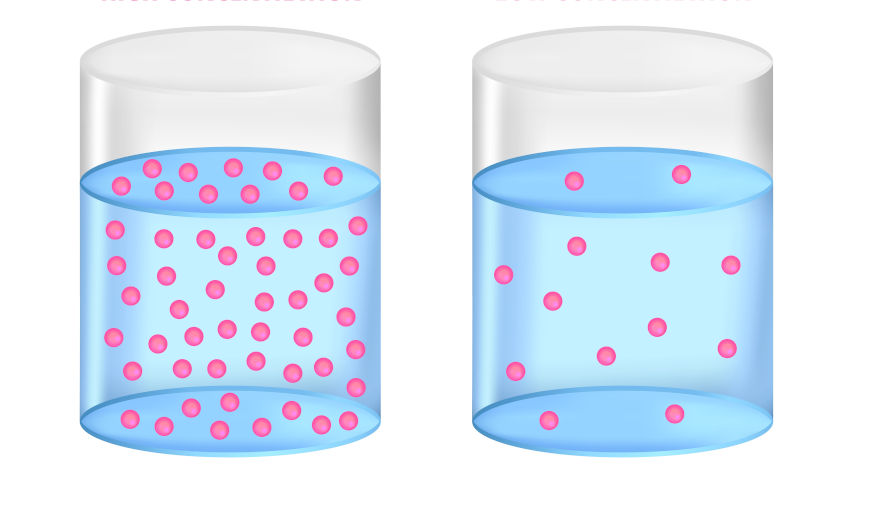
Assim sendo, quanto maior a concentração dos reagentes, maior a velocidade da reação química. Saiba mais sobre a concentração dos reagentes clicando aqui.
→ Superfície de contato
A superfície de contato tem relação direta com o número de partículas que participam do processo químico simultaneamente. Uma maior superfície de contato implica um maior número de participantes disponíveis para reagir, enquanto uma menor superfície de contato implica menos participantes disponíveis para o processo químico.
Quanto maior a superfície de contato, maior o número de colisões por intervalo de tempo e, assim sendo, maior a probabilidade de colisões efetivas. Por isso, o aumento da superfície de contato acelera a reação química. Do contrário, a menor superfície de contato faz diminuir a velocidade da reação química.
→ Temperatura
Como antes dito, uma colisão efetiva necessita, dentre outros fatores, de energia suficiente para desencadear o processo químico, ou seja, de uma energia suficientemente grande para romper as ligações das moléculas dos reagentes. Essa energia mínima necessária para desencadear uma reação química é chamada de energia de ativação.
A temperatura é uma medida da energia cinética de um corpo. Quanto maior a temperatura, maior a energia cinética, ou seja, com mais velocidade as partículas se movimentam. Partículas que se movimentam com maior energia cinética apresentam colisões mais energéticas, o que possibilita que um maior número de colisões supere a energia de ativação do processo reacional.
Logo, quanto maior a temperatura, maior a energia das colisões entre as partículas e maior a probabilidade de se superar a energia de ativação da reação química. De modo análogo, a queda da temperatura retira energia cinética das partículas envolvidas no processo reacional e, assim sendo, dificulta que as colisões atinjam a energia de ativação, o que torna o processo químico mais lento.
→ Catalisador
O catalisador é uma substância química que pode estar dispersa homogeneamente ou não no meio reacional. Seu objetivo é criar uma rota reacional, a qual terá, obrigatoriamente, uma menor energia de ativação. Essa nova rota reacional, com condições energéticas mais brandas, permitirá que algumas colisões, que antes não superavam a barreira da energia de ativação, agora consigam superá-la. Por isso, os catalisadores conseguem acelerar o processo reacional.
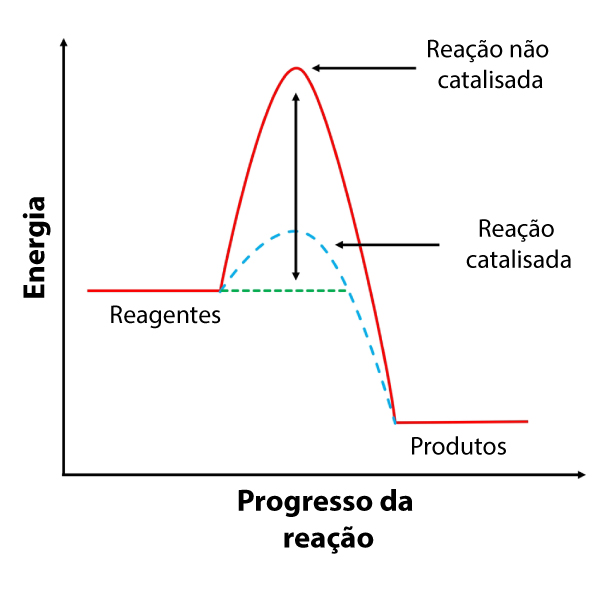
Outra vantagem do catalisador é que ele é regenerado quimicamente ao fim do processo, ou seja, não é consumido, diminuindo a sua quantidade necessária e aumentando a sua vida útil. Por isso, os campos de pesquisa em catalisadores são de grande interesse para a indústria, pois buscam catalisadores cada vez mais seletivos (que atuem sobre um único processo específico), duradouros (catalisadores são degradados fisicamente) e baratos. Saiba mais sobre catalisadores clicando aqui.
O que determina a velocidade de uma reação química?

A velocidade média de uma reação química é dada pela taxa de consumo dos reagentes (ΔR), ou pela taxa de produção dos produtos (ΔP), em determinado intervalo de tempo (Δt). Quanto maior a variação na concentração dos participantes, maior será a velocidade.
\(v_{média} = \frac{[\Delta R]}{\Delta t} = \frac{[\Delta P]}{\Delta t}\)
Claro que a velocidade da reação química está intimamente ligada aos fatores necessários para a ocorrência de uma reação química. Esses fatores, meramente qualitativos, descrevem a chamada teoria das colisões. Segundo a teoria das colisões, toda reação química precisa seguir os seguintes fatores:
- afinidade química e contato entre os reagentes;
- orientação adequada para colisão;
- energia cinética mínima de colisão.
No que diz respeito à orientação adequada, devemos entender que as moléculas são entes tridimensionais e, nem sempre, o sítio reativo é atingido corretamente. Para tal, imagina-se os átomos como pequenas esferas simétricas. Para a formação dos produtos desejados, os átomos necessários devem colidir na posição adequada.
Já quanto à energia cinética mínima, toda reação química necessita de um gatilho energético, o qual será necessário para romper as ligações químicas dos reagentes, um processo endotérmico. Por isso, quanto mais fortes as ligações químicas dos reagentes, maior esse gatilho energético, conhecido como energia de ativação. Quando todos os fatores são atingidos, dizemos que a colisão que ocorreu é efetiva.
Saiba mais: Como se calcula a velocidade de uma reação química?
Exercícios resolvidos sobre fatores que influenciam a velocidade das reações químicas
Questão 1. (Uece 2ª fase 2º dia/2024.2) A cinética química estuda a velocidade das reações químicas e os fatores que a influenciam. Em relação a esses fatores, analise as seguintes proposições:
- Quanto maior a superfície de contato, maior a velocidade da reação química.
- Catalisadores criam um mecanismo mais curto para o desenvolvimento das reações químicas.
Considerando as proposições acima apresentadas, é correto afirmar que
- I é verdadeira e II é falsa.
- I é falsa e II é verdadeira.
- ambas são falsas.
- ambas são verdadeiras.
Resposta: Letra D.
A superfície de contato, quando aumentada, aumenta a velocidade da reação química, uma vez que aumenta o número de partículas participantes no processo, aumentando, assim, o número de colisões por intervalo de tempo. Já os catalisadores são substâncias que criam rotas alternativas para as reações químicas, em que se destaca o fato de haver uma menor energia de ativação.
Questão 2. (UEA-SIS 1ª série/2025-2027) O papel é um material formado por celulose, uma molécula com propriedades combustíveis. No entanto, o simples contato do papel com o oxigênio do ar não é suficiente para iniciar uma reação de combustão. Uma maneira de iniciar a combustão do papel é utilizar uma lente de aumento para convergir os raios solares para um ponto de uma folha de papel, como ilustrado na figura.
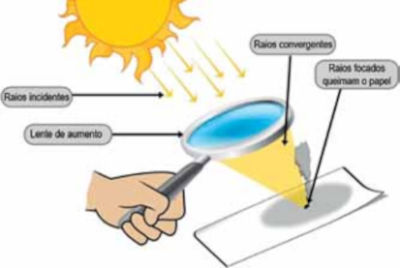
(www.scienceabc.com. Adaptado.)
Segundo a teoria das colisões efetivas, o uso da lente de aumento inicia a combustão do papel porque
- promove o aumento da superfície de contato entre a celulose do papel e o oxigênio do ar.
- aumenta a energia de ativação do sistema.
- faz com que os raios solares concentrem o oxigênio do ar em torno do papel.
- aumenta a agitação molecular das substâncias reagentes, tornando as colisões mais eficazes.
- atua como catalisador, tornando a reação mais rápida.
Resposta: Letra D.
A lente de aumento direciona os raios solares para o papel (combustível), aumentando a temperatura naquela região. Dessa forma, as moléculas que antes não superavam a energia de ativação para reagir com o gás oxigênio do ar agora têm condições para tanto, pois há um aumento na energia cinética média das partículas, tornando as colisões mais efetivas e o processo mais rápido de acontecer.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FUNDAÇÃO CECIERJ. Estudo da velocidade das reações: Cinética Química. In: Química. Fascículo 5, unidade 13. Rio de Janeiro: Fundação CECIERJ, 2016.