Fração molar
A fração molar de uma solução é um tipo de concentração que utiliza dados como número de mol, massa e massa molar. Pode ser relacionada com o título em massa.
Por Diogo Lopes Dias

PUBLICIDADE
A fração molar é uma modalidade de concentração de soluções em que o número de mol (na) de um componente específico (soluto ou solvente) é dividido pelo número de mol (n) de toda a solução.
O número de mol da solução (n) é determinado pela soma do número de mol do soluto (n1) com o número de mol do solvente (n2).
Veja também: Mol
Fração molar do soluto e do solvente
A fração molar é sempre calculada de forma individual para o soluto e para o solvente, ou seja, não se trabalha a fração molar da solução, e sim a fração molar dos componentes dessa solução. Assim, quando o exercício fornecer o número de mol do soluto (n1), basta dividi-lo pelo número de mol da solução (n) para determinar a fração molar do soluto (X1):
Quando o exercício fornecer o número de mol do solvente (n2), basta dividi-lo pelo número de mol da solução (n) para determinar a fração molar do solvente (X2):
Quando o exercício não fornecer o número de mol do soluto e o número de mol do solvente, devemos calculá-los por meio das massas de cada um e suas massas molares.
m1: massa do soluto presente na solução;
M1: massa molar.
m2: massa do solvente presente na solução;
M2: massa molar.
Intervalo de variação da fração molar
Como o número de mol da solução é a soma entre o número de mol do soluto e o número de mol do solvente, o denominador da fração molar do soluto e do solvente sempre será maior que o numerador.
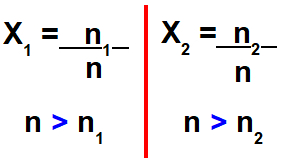
Fórmula e relações de grandeza na fração molar.
Sempre que o denominador de uma divisão é maior que o numerador, o resultado final fica entre 0 e 1. Assim, quando realizado o cálculo da fração molar, o resultado deve estar entre zero e um.
A solução é a resultante da soma entre o soluto e o solvente. A somatória entre os valores das frações molares do soluto e do solvente resultar é igual a 1.
'Fração molar e porcentagem
Como os resultados das frações molares do soluto e do solvente estão sempre entre 0 e 1, podemos transformá-los em porcentagem. Para isso, bastar multiplicar o resultado por 100.
A somatória das porcentagens resulta sempre em 100%.
Fração molar e molalidade
Molalidade (W) é uma modalidade de concentração de soluções que pode ser calculada pela relação entre o número de mol do soluto (n1) e a massa do solvente (m2) ou pela relação entre a massa do soluto (m1) e o produto entre a massa molar do soluto (M1) e a massa do solvente.
Fração molar e pressão parcial
A relação matemática entre a pressão parcial de um gás (Pa) e a pressão total do sistema (PT) é sempre igual à fração molar do gás (Xa).
Conhecendo a fração molar de um gás qualquer e a pressão total do sistema, podemos determinar a pressão parcial do gás. Isso também se aplica à pressão total do sistema.
Relação entre a fração molar e o título em massa da solução
Quando o exercício envolver fração molar e título (T), devemos conhecer a expressão matemática utilizada para calcular o título.
Vale destacar que a massa da solução (m) é a soma entre a massa do soluto (m1) e a massa do solvente (m2).
Exercícios resolvidos sobre fração molar
Exercício 1 - Uma solução preparada tomando-se 1 mol de glicose e 99 mol de água apresenta frações molares de soluto e solvente, respectivamente, iguais a:
a) 0,18 e 0,82.
b) 0,82 e 0,18.
c) 0,90 e 0,10.
d) 0,10 e 0,90.
e) 0,01 e 0,99.
Resolução: letra e.
Dados
-
Número de mol do soluto (n1) = 1 mol
-
Número de mol do solvente (n2) = 99 mol
-
Número de mol da solução (n) = 100 mol (após somar os valores do soluto e do solvente)
-
Cálculo da fração molar do soluto:
-
Cálculo da fração molar do solvente:
Exercício 2: A fração molar da glicose (C6H12O6) em uma solução aquosa é 0,01. Podemos afirmar que o título em massa da solução vale, aproximadamente:
Dados: massa molar da glicose: 180g/mol; massa molar da água: 18 g/mol.
a) 0,01%
b) 0,83%
c) 1,00%
d) 9,17%
e) 90,9%
Resolução: letra d.
O único dado que o exercício forneceu foi a fração molar do soluto (X1): 0,01 (ou seja, 1 centésimo). Como ela envolve a divisão entre o número de mol do soluto e o número de mol da solução, podemos fazer a seguinte relação matemática:
A partir dessa relação matemática, temos que o número de mol do soluto (n1) é igual a 1 mol, e o número de mol da solução (n) é igual a 100 mol. Como a solução é igual à soma entre soluto e solvente, o número de mol do solvente é 99 mol.
Para calcular o título, é necessário transformar o número de mol do soluto e o número de mol do solvente em massa.
-
Cálculo da massa do soluto (m1)
n1 = m1
M1
1 = m1
180
m1 = 180 g
-
Cálculo da massa do solvente (m2)
Obs.: a massa da solução (m) é 1962 g (após somar os valores do soluto e do solvente).
-
Cálculo do título
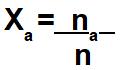
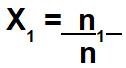
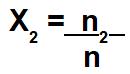
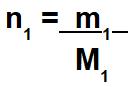
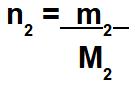

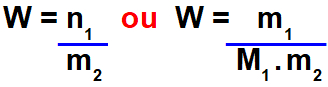
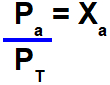
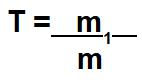
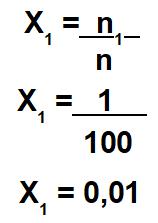
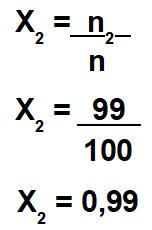
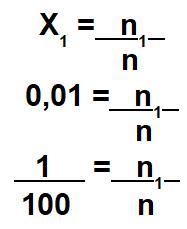
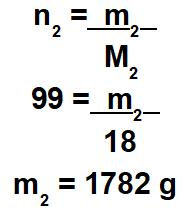




![Apesar de não ter sido descoberto por Avogadro, a constante leva seu nome devido à sua importante contribuição. [1] Apesar de não ter sido descoberto por Avogadro, a constante leva seu nome devido à sua importante contribuição. [1]](https://static.manualdaquimica.com/2020/01/avogrado.jpg)