Mistura de soluções de mesmo soluto
Uma mistura de soluções de mesmo soluto ocorre quando duas ou mais soluções que apresentam o mesmo soluto e o mesmo solvente são adicionadas em um único recipiente.
Por Diogo Lopes Dias

PUBLICIDADE
Quando colocamos em um mesmo recipiente duas soluções que apresentam o mesmo soluto, estamos realizando o que na Química é chamado de mistura de soluções de mesmo soluto. Como o soluto é o mesmo, não há a ocorrência de uma reação química. Vale ressaltar que, além do mesmo soluto, essas soluções apresentam também o mesmo solvente. Veja um exemplo:
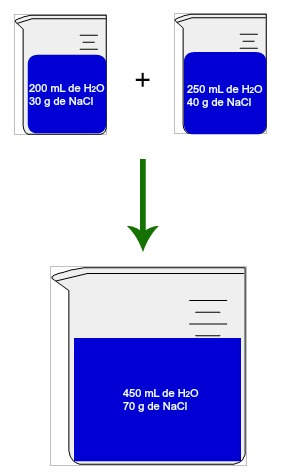
Duas soluções aquosas de cloreto de sódio representando uma mistura de soluções de mesmo soluto
A imagem acima ilustra bem o que ocorre em uma mistura de soluções de mesmo soluto. Podemos observar que a mistura de duas soluções, uma com 200 mL de H2O e a outra com 250 mL de H2O, resulta em uma solução final cujo volume é de 450 mL de H2O. Como o solvente delas é o mesmo, podemos realizar a soma dos volumes do material líquido presente para determinar o volume final. O mesmo procedimento de soma deve ser realizado com a massa do soluto, já que ele é o mesmo em ambas as soluções. Como uma tem 30 g de NaCl e a outra tem 40 g de NaCl, a solução final apresenta 70 g de NaCl. Resumindo:
-
Para o volume:
|
Volume final = Volume da solução 1 + Volume da solução 2 |
-
Para a massa do soluto:
|
Massa do soluto final = massa do soluto 1 + massa do soluto 2 |
Observação: Independentemente do número de soluções que foram utilizadas (duas, três, quatro ou mais soluções), a somatória das massas dos solutos e dos volumes sempre será realizada.
A fórmula da concentração comum é a seguinte:
C = m1
V
- C é a concentração comum;
- m1 é a massa do soluto;
- V é o volume da solução.
Isolando a massa do soluto, temos que:
m1 = C.V
Como na mistura de soluções, as massas do soluto são somadas:
m1F = m1, + m1,,
Podemos substituir C.V no lugar de m1. Assim, chegamos à fórmula para trabalhar a concentração comum em mistura de soluções de mesmo soluto:
CF.VF = C1.V1 + C2.V2
-
CF = concentração da solução final
-
VF = volume da solução final
-
C1 = concentração da solução 1
-
V1= volume da solução 1
-
C2 = concentração da solução 2
-
V2 = volume da solução 2
O mesmo processo pode ser feito com a molaridade, cuja fórmula é:
M = m1
M1.V
-
M é a molaridade;
-
m1 é a massa do soluto;
-
V é o volume da solução;
-
M1 é a massa molar do soluto.
Não pare agora... Tem mais depois da publicidade ;)
Isolando a massa do soluto, temos que:
m1 = M.M1.V
Observação: Como o soluto é o mesmo, podemos descartar a massa molar do soluto (M1). Assim, a fórmula da mistura de soluções de mesmo soluto envolvendo a molaridade é:
MF.VF = M1.V1 + M2.V2
-
MF = molaridade da solução final
-
M1 = molaridade da solução 1
-
M2 = molaridade da solução 2
Vamos ver agora alguns exemplos de cálculos que envolvem a mistura de soluções de mesmo soluto:
1º) Se misturarmos 400 mL de uma solução aquosa de NaCl 0,2 mol/L com 250 mL de outra solução de NaCl 0,4 mol/L, teremos uma nova solução. Qual será a concentração em mol/L da solução final?
Dados do exercício:
V1 = 400 mL
M1 = 0,2 mol/L
V2 = 250mL
M2 = 0,4 mol/L
VF = V1 + V2
VF = 650 mL
MF = ?
Utilizando a fórmula de mistura de soluções de mesmo soluto referente à molaridade, temos:
MF.VF = M1.V1 + M2.V2
MF.650 = 0,2.400 + 0,4.250
MF.650 = 80 + 100
MF.650= 180
MF = 180
650
MF = 0,27 mol/L
2º) (UERGS) Qual deve ser o volume em litros de uma solução de HNO3 0,1 mol/L que deve ser adicionado a 5 litros de uma solução de HNO3 0,5 mol/L para obter uma solução final de concentração igual a 0,2 mol/L?
Dados do exercício:
V1 = ?
M1 = 0,1 mol/L
V2 = 5 L
M2 = 0,5 mol/L
VF = V1 + V2
VF = V1 + 5
MF = 0,2 mol/L
Utilizando a fórmula de mistura de soluções de mesmo soluto referente à molaridade, temos:
MF.VF = M1.V1 + M2.V2
0,2. (V1 + 5) = 0,1.V1 + 0,5.5
0,2. V1 +1 = 0,1.V1 + 2,5
0,2. V1 - 0,1.V1 = 2,5 – 1
0,1.V1 = 1,5
V1 = 1,5
0,1
V1 = 15 L
3º) Sabe-se que a concentração molar de uma solução X de ácido nítrico é o triplo da concentração molar de outra solução Y do mesmo ácido. Ao misturar 200 mL da solução X com 600 mL da solução Y, obtém-se uma solução com concentração igual a 0,3 mol/L do mesmo ácido. Quais são as molaridades das soluções X e Y?
Dados do exercício:
V1 = 200 mL
M1 = 3x
V2 = 600mL
M2 = x
VF = V1 + V2
VF = 800 mL
MF = 0,3 mol/L
Utilizando a fórmula de mistura de soluções de mesmo soluto referente à molaridade, temos:
MF.VF = M1.V1 + M2.V2
0,3.800 = 3x.200 + x.600
240 = 600x + 600x
240 = 1200x
x = 240
1200
x = 0,2 mol/L
Assim, a molaridade da solução 1 será de 0,6 mol/L (por ser o triplo da solução 2) e a molaridade da solução 2 será de 0,2 mol/L.
Aproveite para conferir nossas videoaulas relacionadas ao assunto:






