Reatividade dos ametais
A fila de reatividade dos ametais permite identificar se determinadas reações de oxirredução ou simples troca ocorrerão ou não.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
No texto Reatividade dos metais foi demonstrado experimentalmente que alguns metais são mais reativos que outros, ou seja, alguns têm maior tendência de perder elétrons (oxidação) e assim realizar reações de oxirredução. Isso permite determinar se uma reação de deslocamento ocorrerá ou não.
Algo similar ocorre com os ametais mostrados a seguir:
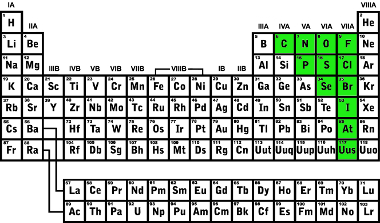
Elementos classificados como ametais na tabela periódica
Alguns ametais também são mais reativos que outros. Porém, a diferença é que, no caso dos ametais, a reatividade tem a ver com a eletronegatividade, isto é, com a tendência de atrair elétrons (redução). Quanto mais reativo o metal for, maior será a sua tendência de reduzir-se.
Quando a água de cloro (Cl2(aq)) e o iodeto de potássio (KI(aq)) reagem, observa-se a formação de um precipitado marrom, como mostra a figura do início deste artigo. Veja qual é a reação que ocorre:
Cl2(aq) + 2 KI(aq) → 2 KCl(aq) + I2(aq)
ou
Cl2(aq) + 2 K+(aq) + 2 I-(aq) → 2 K+(aq) + 2 Cl-(aq) + I2(aq)
ou
Cl2(aq) + 2 I-(aq) → 2 Cl-(aq) + I2(aq)
O precipitado marrom é o iodo (I2) que foi formado. Veja que o cloro desloca o íon iodeto (I-) do iodeto de potássio (KI), o que mostra que o cloro é mais reativo que o iodo.
Se analisarmos a transferência de elétrons, veremos que o cloro reduziu (ganhou elétrons), pois seu número de oxidação (Nox) diminuiu de zero para -1. O íon iodeto foi quem perdeu esses elétrons (oxidou), tendo seu Nox aumentado de -1 para zero.
Por outro lado, se colocarmos o iodo para reagir com o cloreto de potássio, a reação não ocorrerá, porque o iodo é menos reativo que o cloro e não consegue deslocá-lo:
KCl(aq) + I2(aq)→ reação não ocorre espontaneamente
Outro exemplo é mostrado a seguir na reação entre o flúor e o cloreto de sódio:
F2(aq) + 2 NaCl(aq) → 2 NaF(aq) + Cl2(aq)
Veja que o flúor deslocou o cloro, o que evidencia que, entre esses dois ametais, o flúor é o mais reativo.
Por métodos experimentais descobriu-se a fila de reatividade dos ametais principais, que é dada pela seguinte ordem crescente:
F > O > N > Cl > Br > I > S > C
Usando essa fila de reatividade dos ametais, podemos prever se a reação ocorrerá ou não. Se a substância simples na reação for formada pelo ametal mais reativo (à esquerda na ordem acima), então a reação ocorrerá.
O flúor é, portanto, o ametal mais reativo, enquanto o carbono é o menos reativo.
Existe um macete para lembrar a fila de reatividade dos ametais, que é dada pelas letras das palavras na frase a seguir:
“Fui Ontem No Clube, Briguei e Saí Correndo.”
Por Jennifer Fogaça
Graduada em Química