Reatividade dos metais
A reatividade dos metais consiste na capacidade de um metal perder elétrons durante uma reação química. Quanto mais facilmente oxida em meio reacional, mais reativo é o metal.
Por Stéfano Araújo Novais

PUBLICIDADE
A reatividade dos metais consiste na capacidade da espécie metálica em perder elétrons em um meio reacional, ou seja, a facilidade de oxidação do metal. Um metal com grande tendência a oxidar tem alta reatividade. Uma forma de se enxergar tal reatividade é utilizando-se de uma tabela de potenciais-padrão de redução.
A reatividade dos metais pode ser vista em tabelas de potenciais-padrão de redução, pois lá estão valores de potenciais elétricos desses metais, os quais podem medir a tendência do metal a se manter na sua forma reduzida. Quanto maior o potencial-padrão de redução, mais dificilmente o metal perde elétrons e, portanto, menos reativo é.
Com base no que é visto nas tabelas de potenciais-padrão de redução, é possível dividir os metais em grupos de reatividade, assim criando a fila de reatividade de metais, de mais fácil visualização e comparação.
Leia também: Oxidação e redução — como ocorrem esses processos?
Resumo sobre a reatividade dos metais
- A reatividade dos metais está ligada à capacidade da espécie metálica em perder elétrons.
- Quanto mais facilmente oxida em um meio reacional, mais reativo é esse metal.
- Pode-se utilizar uma tabela de potenciais-padrão de redução para saber quais metais são mais ou menos reativos.
- A tabela de potenciais-padrão de redução permite diferenciar, por meio dos potenciais elétricos, as espécies metálicas que têm maior ou menor tendência a se manterem na forma metálica (forma reduzida).
- A fila de reatividade de metais é um recurso interessante para se diferenciar as reatividades dos metais, dividindo-os em grupos quanto a essa propriedade.
O que é a reatividade dos metais?

Os metais são espécies químicas com caráter eletropositivo, dada sua baixa energia de ionização. Isso quer dizer que são átomos que têm grande tendência a perderem elétrons de valência em processos químicos, os quais também são chamados de oxidação.
Sendo assim, a reatividade dos metais tem a ver com a capacidade do átomo metálico em perder elétrons durante uma reação química, ou seja, a facilidade com que um metal se oxida em uma reação. Quanto mais facilmente o metal perder esse elétron, mais reativo ele será.
Como saber qual metal é mais reativo?
Uma forma muito comum de se entender quais metais são mais ou menos reativos é por meio de uma tabela de potenciais-padrão de redução. Lá estão expostos os valores necessários, em termos de potencial elétrico (V), para que um metal consiga sofrer uma reação de redução. A interpretação da tabela é simples:
- Quanto mais positivo (ou menos negativo) o potencial-padrão de redução, maior a tendência do metal se manter na forma reduzida, ou seja, maior a dificuldade em perder elétrons.
- Quanto mais negativo (ou menos positivo) o potencial-padrão de redução, menor a tendência do metal em se manter na forma reduzida, ou seja, maior a facilidade em perder elétrons.
Tais valores foram obtidos experimentalmente com base no potencial elétrico gerado por essas espécies metálicas com um eletrodo de referência, conhecido como eletrodo-padrão de hidrogênio (EPH), cujo valor convencionado é zero.
Eis alguns metais extraídos de uma tabela de potenciais-padrão e com base em seus estados de oxidação mais comuns.
|
Metal, Mn+/M |
Potencial-padrão de redução (V) |
|
Lítio, Li+/Li |
−3,04 |
|
Césio, Cs+/Cs |
−3,03 |
|
Rubídio, Rb+/Rb |
−2,98 |
|
Potássio, K+/K |
−2,93 |
|
Bário, Ba2+/Ba |
−2,91 |
|
Estrôncio, Sr2+/Sr |
−2,90 |
|
Cálcio, Ca2+/Ca |
−2,87 |
|
Rádio, Ra2+/Ra |
−2,80 |
|
Sódio, Na+/Na |
−2,71 |
|
Magnésio, Mg2+/Mg |
−2,37 |
|
Berílio, Be2+/Br |
−1,85 |
|
Alumínio, Al3+/Al |
−1,66 |
|
Zinco, Zn2+/Zn |
−0,76 |
|
Ferro, Fe2+/Fe |
−0,45 |
|
Cádmio, Cd2+/Cd |
−0,40 |
|
Cobalto, Co2+/Co |
−0,28 |
|
Níquel, Ni2+/Ni |
−0,26 |
|
Chumbo, Pb2+/Pb |
−0,13 |
|
Hidrogênio, H+/H2 |
0,00 |
|
Cobre, Cu2+/Cu |
+0,34 |
|
Rutênio, Ru2+/Ru |
+0,45 |
|
Ródio, Rh2+/Rh |
+0,60 |
|
Prata, Ag+/Ag |
+0,80 |
|
Mercúrio, Hg2+/Hg |
+0,85 |
|
Paládio, Pd2+/Pd |
+0,95 |
|
Irídio, Ir3+/Ir |
+1,16 |
|
Platina, Pt2+/Pt |
+1,18 |
|
Ouro, Au3+/Au |
+1,50 |
|
Ouro, Au+/Au |
+1,70 |
Assim, pela análise da tabela, podemos entender que metais como ouro, platina, irídio, paládio, mercúrio e prata têm baixa reatividade, enquanto metais como sódio, potássio, lítio, magnésio, bário e césio são muito reativos.

Fila de reatividade dos metais
Como a tabela de potenciais-padrão costuma ser extensa e de difícil compreensão para pessoas leigas na área, é comum a utilização da chamada fila de reatividade dos metais — uma escala empírica de reatividade dos metais, porém de mais simples interpretação e avaliação.
Ao observar-se a tabela de potenciais-padrão, percebe-se a seguinte tendência:
- Os metais alcalinos e alcalino-terrosos são as espécies metálicas mais reativas.
- Os metais como ouro, prata, cobre, mercúrio e os metais do grupo da platina (Pt, Pd, Ir, Rh e Ru) são as espécies metálicas menos reativas.
- Os demais metais compõem uma escala intermediária de reatividade, sendo um pouco mais reativos se comparados ao hidrogênio do eletrodo-padrão de hidrogênio.
Assim, é possível estabelecer a seguinte fila de reatividade decrescente:
|
São chamados de metais comuns os metais de reatividade intermediária, muito presentes em nosso cotidiano. Já os metais nobres compõem os metais de alto valor agregado e/ou de baixa reatividade química.
Essa fila permite uma comparação mais rápida entre as reatividades, colocando os metais em grupos específicos quanto a essa propriedade. Contudo, para uma análise mais minuciosa, por exemplo, quando se deseja comparar a reatividade de dois metais alcalinos, faz-se necessária a utilização da tabela de potenciais-padrão de redução.
Saiba mais: Como calcular o NOX dos elementos químicos?
Exercícios resolvidos sobre a reatividade dos metais
Questão 1. (Uece 2ª Fase 2º dia/2023.1) O elemento químico sódio (Na) é um metal alcalino, fundamental para as funções do organismo, pois equilibra a quantidade e a distribuição da água no corpo, ajudando, assim, a regular a pressão arterial.
Quando um pedaço desse metal é diretamente introduzido na água, ocorre uma reação química violenta, desprendendo o gás
- O2.
- H2.
- Na2O.
- NaO.
Resposta: Letra B.
O sódio é um metal muito reativo. No caso, em reação com a água, observa-se:
Na (s) + H2O (l) → Na2O (s) + H2 (g)
Assim, é possível perceber o desprendimento de gás hidrogênio, H2.
O óxido de sódio é concomitantemente dissolvido.
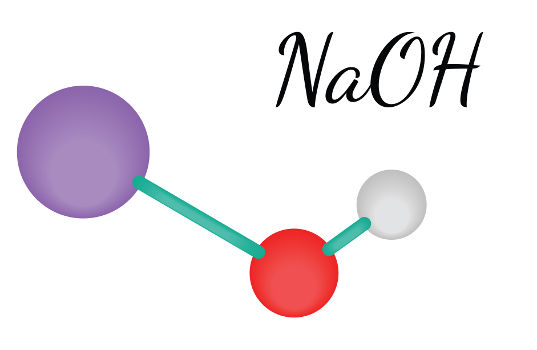
Na2O (s) + H2O (l) → 2 NaOH (aq)
Questão 2. (Uece 1ª Fase/2022.1) O alquimista e médico Paracelso (Philippus Aureolus Teophrastus Bombastus Van Hoheneim, 1493–1541), no início do século dezesseis, havia inconscientemente observado que, na reação em que os ácidos atacam os metais, havia um subproduto gasoso.
Esse gás é o
- oxigênio.
- hidrogênio.
- gás carbônico.
- nitrogênio.
Resposta: Letra B.
Os ácidos, que aqui representaremos como HX, podem reagir com metais, representados por M. Nessa reação, o hidrogênio é deslocado, formando o gás hidrogênio, conforme a reação não balanceada a seguir (apenas para fins didáticos).
M (s) + HX (aq) → MX (aq) + H2 (g)
Créditos da imagem
[1] julien mcroberts/ Shutterstock
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FELTRE, R. Química. V. 1, 6ª ed. Moderna: São Paulo, 2004.