Afinidade eletrônica
A afinidade eletrônica é uma propriedade que estuda a energia liberada por um átomo ao receber um elétron.
Por Diogo Lopes Dias
PUBLICIDADE
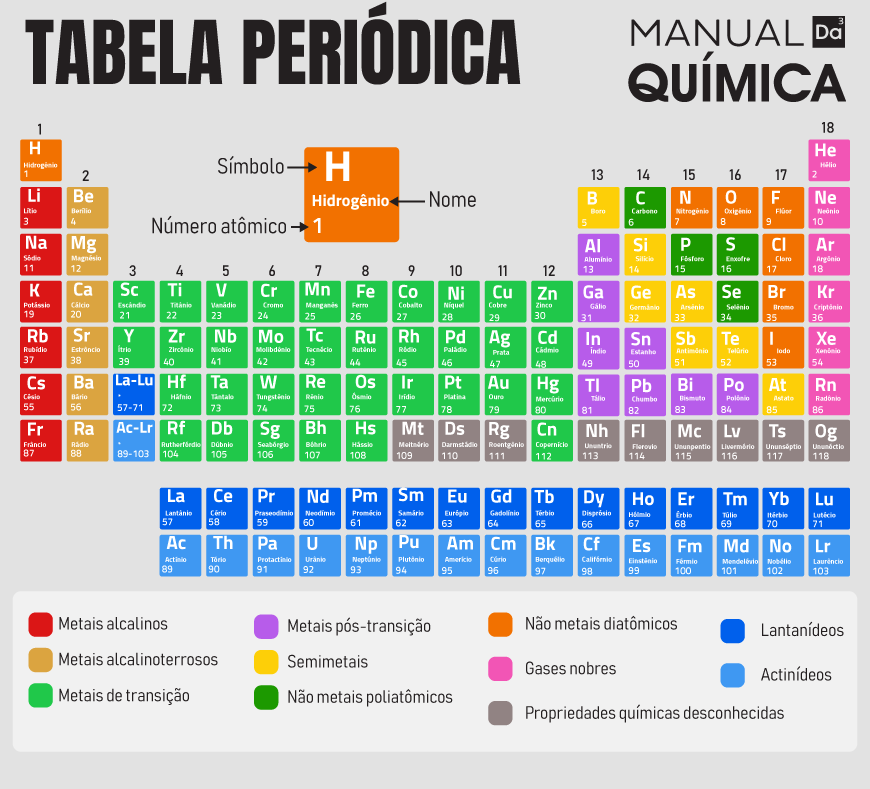
A Tabela Periódica atual foi organizada por Moseley, em 1913, e colocou os elementos químicos em ordem crescente de número atômico (Z). Essa organização favoreceu a disposição dos elementos em famílias (colunas verticais) e períodos (colunas horizontais). Os elementos dispostos em ordem crescente de número atômico favoreceram a visualização da periodicidade das propriedades que os elementos apresentavam (lei periódica).
Um exemplo da lei periódica (toda família periódica apresenta elementos com propriedades químicas semelhantes) são os gases nobres, que são elementos gasosos e pouco reativos. O mais interessante sobre a periodicidade dos gases nobres é que todo elemento anterior a eles é um ametal e todo elemento posterior é um metal.
O exemplo acima mostra que o estudo das propriedades periódicas dos elementos é importante porque nos fornece certa noção sobre as várias características e comportamentos que os átomos dos elementos podem apresentar, a depender da ordem do número atômico.
A afinidade eletrônica ou eletroafinidade, que é uma das propriedades periódicas existentes, avalia a quantidade de energia liberada quando um átomo em seu estado fundamental (neutro) recebe um elétron. A equação a seguir representa a afinidade eletrônica:
X(g) + e → X-(g) + energia
A afinidade eletrônica é uma propriedade extremamente difícil de ser medida. Muitos elementos não apresentam o valor dela definido experimentalmente e, em alguns casos, essa propriedade é teórica ou foi calculada em função do número atômico. Em outros casos, ela é simplesmente ignorada, como no caso dos gases nobres, que apresentam orbitais completos (ns2 np6) na camada de valência e são muito estáveis.
Existem casos em que o valor da afinidade eletrônica é negativo, o que significa que, ao receber um segundo elétron, o átomo absorve energia, e não a libera (isso ocorre principalmente quando o átomo tornou-se um ânion após receber um primeiro elétron). Veja as equações a seguir que representam esse fato:
O(g) + e- → O-(g) + energia
O-(g) + e- → O-2(g)
Observação: Existe força de repulsão entre o ânion formado na primeira adição e o segundo elétron que está sendo adicionado. Isso faz com que uma energia seja gasta para que esse novo elétron entre no ânion.
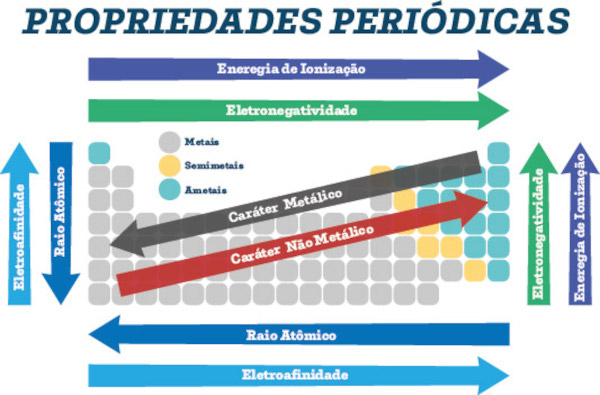
Ao estudar a Tabela Periódica, é possível comparar a afinidade eletrônica de vários elementos químicos. Para isso, vamos levar em consideração três aspectos:
-
Raio atômico: quanto menor for o tamanho de um átomo, maior será a sua afinidade eletrônica. Isso ocorre porque a força de atração do núcleo em relação aos elétrons da periferia é maior.
↓R.A – ↑A.E
↑R.A – ↓A.E -
Período: em um mesmo período, quanto maior for o número atômico, maior será a afinidade eletrônica. Isso ocorre porque quanto mais prótons existirem no núcleo, maior será a força de atração nuclear em relação aos elétrons da periferia. Por isso, no período, a afinidade eletrônica cresce da esquerda para a direita.

Aumento da afinidade eletrônica em um período
-
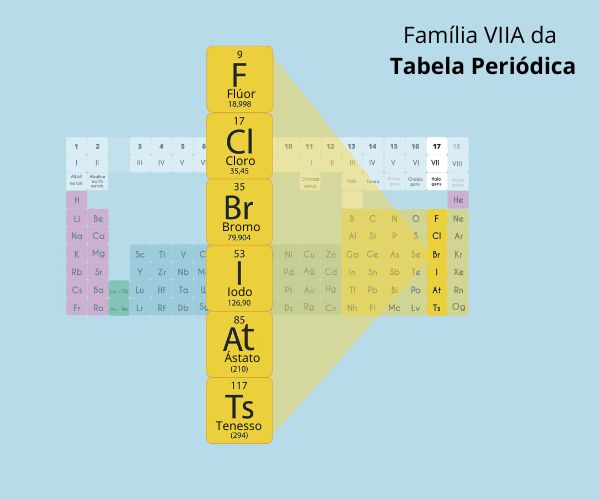
Família: em uma mesma família, quanto menor for o número atômico e o número de níveis, maior será a afinidade eletrônica. Na família, os elementos localizados acima um do outro apresentam menor número atômico e menor número de níveis em seus átomos, o que favorece uma maior força de atração do núcleo em relação aos elétrons da periferia. Assim, em uma família da Tabela Periódica, a afinidade eletrônica cresce de baixo para cima.
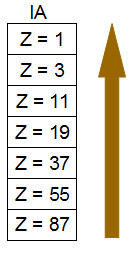
Aumento da afinidade eletrônica em uma família
Após todas essas informações passadas, é fácil chegar à conclusão de que o elemento químico com a menor afinidade eletrônica é o Frâncio, enquanto o elemento de maior afinidade eletrônica é o flúor. Todavia, como toda regra tem exceções, a análise do comportamento dessa propriedade periódica diretamente na tabela é apenas uma previsão, já que o elemento de maior afinidade eletrônica é o Cloro.
Abaixo temos um esquema geral da afinidade eletrônica na Tabela Periódica:
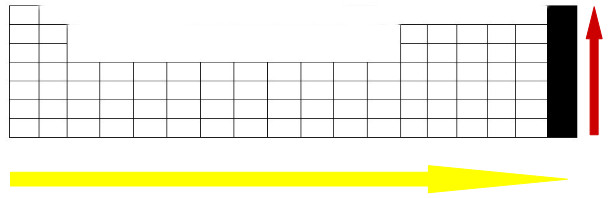
Esquema que representa o aumento da afinidade eletrônica nos períodos e nas famílias da Tabela Periódica
Por Me. Diogo Lopes Dias