Cálculo da carga formal
Se houver dúvidas sobre a estrutura de certa molécula e se ela segue a regra do octeto, basta calcular a carga formal dos átomos.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Visto que existem muitas exceções à regra do octeto, como podemos saber qual é o arranjo entre os átomos de determinada molécula que está correto? Como saber se uma molécula segue ou não a regra do octeto? Para solucionar esse problema, basta realizar o cálculo da carga formal dos átomos nas moléculas que estamos com dúvida.
A carga formal de um átomo é a carga que ele teria se as ligações fossem perfeitamente covalentes e o átomo tivesse exatamente a metade dos elétrons compartilhados nas ligações. Em outras palavras, considera-se o número de elétrons que o átomo deveria ter na molécula, o que inclui os elétrons compartilhados e os pares de elétrons isolados (não ligantes).
Assim, a diferença entre esse número de elétrons que o átomo deveria ter na molécula e o número de elétrons de valência do átomo livre é a carga formal. Isso pode ser expresso por meio da seguinte fórmula matemática:
Carga formal = V - (L + ½ S)
V = quantidade de elétrons de valência do átomo livre;
L = quantidade de elétrons presentes nos pares isolados (não ligantes) do átomo na estrutura;
S = quantidade de elétrons compartilhados pelo átomo na estrutura.
Depois de realizar esse cálculo, a carga formal que estiver mais próxima de zero será a que possui maior probabilidade de existência real.
Por exemplo, imagine que você quer determinar a fórmula eletrônica de Lewis do dióxido de carbono (CO2). Considere as seguintes possibilidades de estrutura de Lewis para essa molécula:
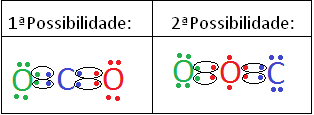
Exemplo para cálculo da carga formal
Qual dessas duas possibilidades corresponde à estrutura real?
Vamos realizar o cálculo da carga formal para cada átomo nas duas estruturas. Veja:
1ª Possibilidade: O = C = O
Oxigênio:
Dados:
V = 6 (a valência livre do oxigênio é essa porque ele pertence à família 16);
L = 4 (existem quatro elétrons não ligantes para esse oxigênio na estrutura 1);
S = 4 (quatro elétrons foram compartilhados com o carbono).
Aplicando na fórmula da carga formal, temos:
CO = V – (L + ½ S)
CO = 6 – (4 + ½ 4)
CO = 6 – (4 + 2)
CO = 0
Carbono:
Dados:
V = 4 (a valência livre do carbono é essa porque ele pertence à família 14);
L = zero (não existe elétron não ligante para o carbono nessa estrutura);
S = 8 (oito elétrons foram compartilhados com os dois oxigênios).
Aplicando na fórmula da carga formal, temos:
CC = V – (L + ½ S)
CC = 4 – (0 + ½ 8)
CC = 4 – 4
CC = 0
Oxigênio:
Dados:
V = 6 (a valência livre do oxigênio é essa porque ele pertence à família 16);
L = 4 (existem quatro elétrons não ligantes para esse oxigênio na estrutura 1);
S = 4 ( quatro elétrons foram compartilhados com o carbono).
Aplicando na fórmula da carga formal, temos:
CO = V – (L + ½ S)
CO = 6 – (4 + ½ 4)
CO = 6 – (4 + 2)
CO = 0
Veja que todos os valores da carga formal para os átomos dessa estrutura deram iguais a zero.
Agora vamos realizar o cálculo da carga formal para os átomos na estrutura 2:
2ª Possibilidade: O = O = C
Oxigênio:
Dados:
V = 6 (a valência livre do oxigênio é essa porque ele pertence à família 16);
L = 4 (existem quatro elétrons não ligantes para esse oxigênio na estrutura 2);
S = 4 (quatro elétrons foram compartilhados com o outro átomo de oxigênio).
Aplicando na fórmula da carga formal, temos:
CO = V – (L + ½ S)
CO = 6 – (4 + ½ 4)
CO = 6 – (4 + 2)
CO = 0
Oxigênio:
Dados:
V = 6 (a valência livre do oxigênio é essa porque ele pertence à família 16);
L = 2 (existem dois elétrons não ligantes para esse oxigênio na estrutura 2);
S = 8 (oito elétrons foram compartilhados com o carbono e com o outro átomo de oxigênio).
Aplicando na fórmula da carga formal, temos:
CO = V – (L + ½ S)
CO = 6 – (2 + ½ 8)
CO = 6 – (2 + 4)
CO = 0
Carbono:
Dados:
V = 4 (a valência livre do carbono é essa porque ele pertence à família 14);
L = 2 (existem dois elétrons não ligantes para o carbono nessa estrutura);
S = 2 (dois elétrons foram compartilhados com o oxigênio).
Aplicando na fórmula da carga formal, temos:
CC = V – (L + ½ S)
CC = 4 – (2 + ½ 2)
CC = 4 – (2 +1)
CC = -1
Observe que, na estrutura 2, o valor do carbono deu igual a -1. Portanto, essa estrutura está descartada. A opção que retrata o arranjo real da molécula é a 1ª possibilidade.
Podemos concluir também que a molécula do dióxido de carbono segue a regra do octeto, pois todos os seus átomos ficaram estáveis com oito elétrons na camada de valência.
Nesse exemplo, os valores das cargas formais de todos os átomos na estrutura 1 deram exatamente iguais a zero. Entretanto, lembre-se de que não será assim em todos os casos. Por isso, você deve considerar os valores que estiverem mais próximos de zero.
Por Jennifer Fogaça
Graduada em Química