Cálculo das Partículas Atômicas
As partículas atômicas principais são: prótons (que é o mesmo que o número atômico), os nêutrons e os elétrons. O número de massa é a soma dos prótons com os nêutrons.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Um elemento químico é caracterizado como sendo formado por um conjunto de átomos que possuem o mesmo número atômico. O número atômico é simbolizado pela letra Z e corresponde à quantidade de cargas positivas - prótons (P) - existentes no núcleo dos átomos.
Por exemplo, o número atômico do sódio é 11, o que significa que ele possui 11 prótons em seu núcleo. No estado fundamental, o átomo é neutro, o que significa que ele possui a mesma quantidade de prótons e de elétrons. Assim, se o átomo de sódio possui 11 prótons, no estado fundamental ele também possui 11 elétrons.
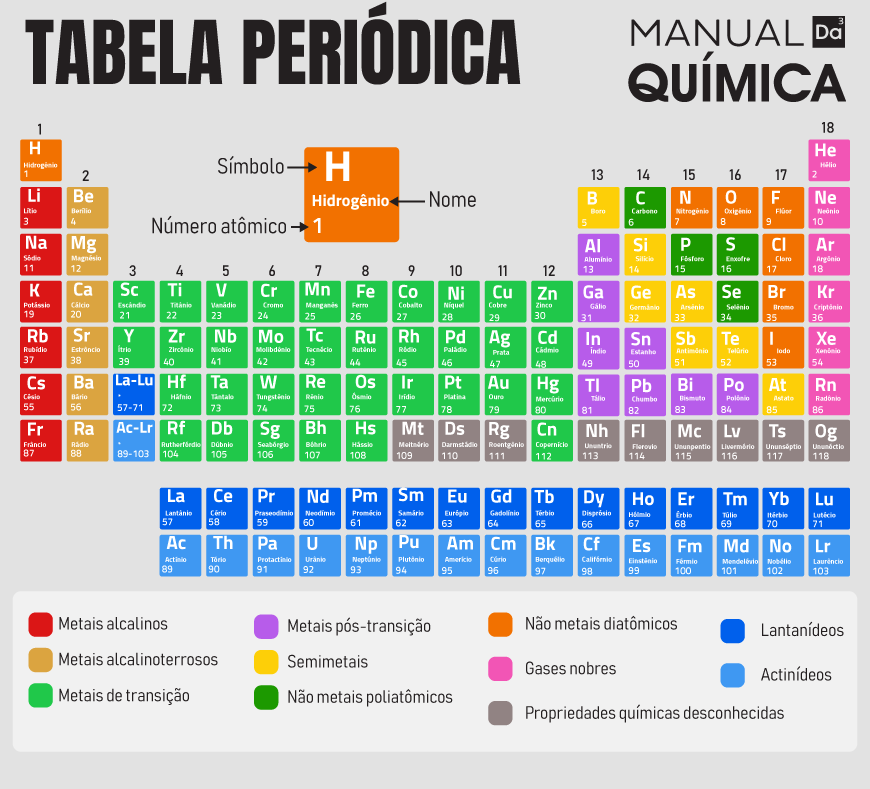
Se quisermos saber qual é o número atômico de qualquer elemento, basta olharmos na Tabela Periódica, pois ela é organizada em ordem crescente de número atômico, começando pelo hidrogênio que tem o número atômico igual a 1, seguido do hélio que tem número atômico igual a 2 e assim por diante. Os números atômicos aparecem em cima do símbolo do elemento ou no lado esquerdo na parte superior, como no exemplo abaixo:

Número atômico do neônio na Tabela Periódica
Visto que os elétrons que ficam na eletrosfera, ao redor do núcleo, possuem massa praticamente desprezível, o número de massa de um átomo, simbolizado pela letra “A”, é a soma do número de prótons (ou número atômico) com o número de nêutrons (N) que estão no núcleo do átomo:
A = P + N ou A = Z + N
Por exemplo, um átomo de sódio possui 11 prótons e 12 nêutrons, então o seu número de massa é igual a 23.
Lembrando que o número de massa (A) indica apenas o número de partículas do átomo que possui massa relevante, porém, essa grandeza não é uma massa e ela é diferente de massa atômica.
Por convenção, os elementos químicos são representados colocando-se o seu símbolo (como aparece na Tabela Periódica) no centro, ao seu lado, na parte superior (do lado esquerdo ou direito), o número de massa (A) e, no lado esquerdo, na parte inferior, o número atômico (Z):
ZAX ou ZXA
No caso do sódio mencionado, a sua representação é a seguinte: 1123Na ou 11Na23.
No caso de um átomo de um elemento químico perder ou ganhar elétrons, ele se torna um íon, ou seja, fica carregado eletricamente, pois o seu número de cargas positivas (prótons) será diferente do seu número de cargas negativas (elétrons). Se ganhar um ou mais elétrons, sua carga será negativa e será denominado de ânion, mas se ele perder um ou mais elétrons, a sua carga será positiva e será chamado de cátion.
ZAXcarga do íon
Por exemplo, o átomo do sódio possui a tendência de perder um elétron, ficando com 11 prótons e 10 elétrons. Visto que ele ficará com uma carga positiva a mais (um próton a mais), ele se tornará um cátion com carga +1 e será representado da seguinte forma: 1123Na1+.
Se um átomo perder dois elétrons, a sua carga ficará sendo 2+, se ele ganhar um elétron, a sua carga será -1; se ele ganhar dois elétrons, a carga passará a ser -2 e assim sucessivamente.
Com base nessas informações, podemos calcular o número atômico ou número de prótons, o número de massa, o número de nêutrons e o número de elétrons dos átomos ou dos íons. Veja como isso pode ser feito nos dois exemplos a seguir:
Exemplo 1:
Um átomo de magnésio possui 12 prótons e número de massa igual a 26. Indique qual é o seu número atômico, o seu número de nêutrons e de elétrons.
Resolução:
Dados:
P = 12
A = 26
-
Visto que o número atômico é o mesmo que a quantidade de prótons, então temos que Z = 12;
-
Esse átomo está no estado fundamental, portanto, a quantidade de elétrons é igual ao número de prótons também: E = 12;
-
O número de massa é a soma dos nêutrons com os prótons, assim temos:
A = P + N
N = A – P
N = 26 – 12
N = 14
Exemplo 2:
Considere o íon 1531P3-. Forneça o número de prótons, nêutrons e elétrons desse ânion.
Resolução:
-
O número de prótons é o número atômico representado no lado inferior esquerdo do elemento. Visto que esse íon ganhou três elétrons, a sua quantidade de prótons permanece a mesma que no estado fundamental, assim temos que os prótons são 15.
-
O número de massa é mostrado no lado superior esquerdo do elemento. Para descobrir o número de nêutrons, usamos a fórmula do número de massa:
A = P + N
N = A – P
N = 31 – 15
N = 16
-
Para descobrir o número de elétrons, temos que raciocinar um pouco: Quando estava no estado fundamental, o número de prótons era igual ao número de elétrons. Portanto, esse átomo possuía inicialmente 15 elétrons. Mas a carga -3 indica que ele ganhou 3 elétrons, assim, agora esse íon possui 18 elétrons.
Videoaulas relacionadas: