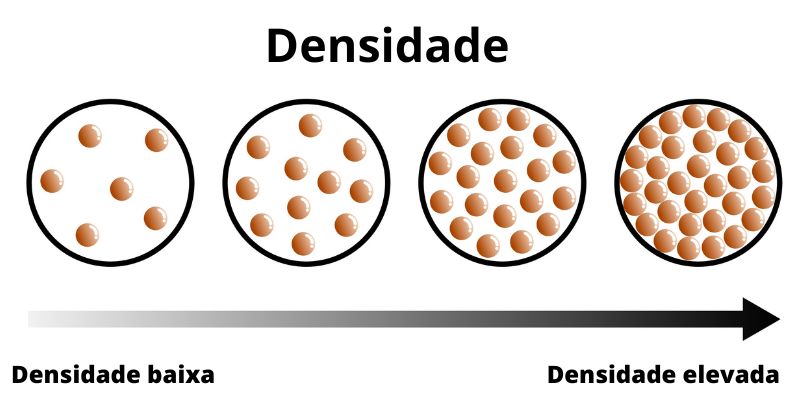
Densidade
A densidade é uma propriedade da matéria que relaciona a massa e o volume de um corpo.
Por Stéfano Araújo Novais

PUBLICIDADE
A densidade é uma propriedade da matéria que relaciona a massa e o volume de um corpo. É muito utilizada na química para caracterizar e identificar substâncias, sendo um parâmetro importante em rotinas de controle de qualidade. A densidade pode ser calculada dividindo-se a massa do objeto pelo seu volume. A densidade também ajuda a indicar se um corpo afundará ou flutuará em um outro fluido, pois ela possui relação com a força peso. Quanto mais denso for o corpo, maior a força peso e, assim, mais ao fundo ele se coloca no sistema.
Leia também: Solubilidade — outra propriedade da matéria
Resumo sobre densidade
- A densidade é uma propriedade da matéria que relaciona a massa e o volume de um corpo.
- É um parâmetro importante na Química, não só para identificar substâncias mas também para caracterizá-las.
- A densidade pode ser utilizada em testes de controle de qualidade.
- A densidade é calculada ao se dividir a massa do corpo pelo seu volume.
- Quanto mais denso for um corpo, mais ao fundo do sistema ele se posiciona.
- A temperatura e a composição química da substância são fatores que influenciam no valor da densidade.
- A densidade, quando fala sobre uma substância pura, é conhecida como massa específica ou densidade absoluta.
- Entre os elementos da Tabela Periódica, o ósmio é o mais denso, enquanto o hidrogênio é o menos denso.
O que é densidade?
A densidade é uma propriedade da matéria que consiste na quantidade de massa de uma amostra dividida pelo seu volume. É caracterizada como uma propriedade intensiva da matéria, ou seja, independe do tamanho da amostra.
Tal grandeza é de grande importância para Química, pois, por vezes, é utilizada para identificar substâncias. Em testes de qualidade, a densidade é também um parâmetro a ser avaliado. Quando vamos a um posto de gasolina, há um densímetro — aparelho utilizado para medir a densidade da substância — acoplado à bomba de combustível. Como a densidade varia com a composição química, adulterações não desejadas no combustível são apontadas pelo densímetro, fazendo com que o consumidor evite abastecer seu veículo.

A densidade é também uma grandeza proporcional à força peso, a qual é calculada como sendo o produto da massa e a aceleração da gravidade. Dessa forma, podemos relacionar a densidade com a flutuabilidade dos corpos em um fluido (líquido ou gasoso). Quanto maior a densidade, maior a força peso e, assim, maior a aceleração do corpo para baixo. Assim sendo, corpos mais densos costumam afundar em corpos menos densos.

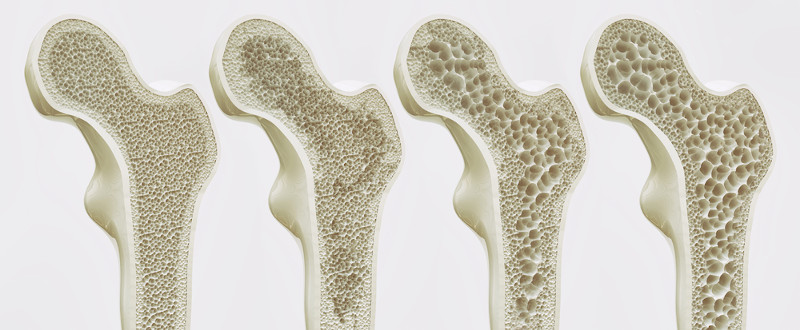
Interessante: A osteoporose, uma das principais doenças ósseas, é causada pela perda de massa óssea, o que torna os ossos mais enfraquecidos e mais suscetíveis a fraturas. Tal doença pode ser diagnosticada por um exame clínico que mensura a densidade de cálcio em nosso tecido ósseo conhecido como densitometria óssea. Quanto menor a densidade de cálcio, mais enfraquecido está o osso e, por isso, exames que apontam baixa densidade óssea podem indicar que o paciente está com osteoporose.
Como calcular a densidade?
Sendo a relação entre a massa e o volume de um corpo, a densidade pode ser calculada pela seguinte equação:
\(densidade=\frac{massa}{volume}\)
Por vezes, a densidade é representada pela letra “d” minúscula ou pela letra grega “rô” (ρ).
Por essa equação, é possível concluir que, quanto mais massa concentrada em determinado volume, mais denso é o corpo.
Quando se deseja calcular a densidade de uma mistura, devemos utilizar uma média ponderada, em que os pesos são os volumes. Assim sendo:
\(densidade=\frac{(d_1\cdot V_1+d_2\cdot V_2+\cdots+d_n\cdot V_n)}{V_1+V_2+\cdots V_n}\)
- d1 → densidade da substância 1
- d2 → densidade da substância 2
- dn → densidade da enésima substância
- V1 → volume da substância 1
- V2 → volume da substância 2
- Vn → volume da enésima substância
Unidade de medida da densidade
Por ser uma relação entre massa e volume, a densidade possui unidades que correlacionam essas duas grandezas, como:
- g/mL ou g.mL-1
- kg/L ou kg.L-1
Também é comum utilizar unidades cúbicas para designar a parte volumétrica, assim sendo, é possível usar também:
- g/cm3 ou g.cm-3
- kg/m3 ou kg.m-3
Vale lembrar que 1 cm3 é equivalente a 1 mL, enquanto 1 dm3 corresponde a 1 litro e 1 m3 corresponde a 1000 L.
Quais são os fatores que afetam a densidade?
A temperatura é um fator que altera a densidade, pelo fato de os corpos dilatarem com o aumento da temperatura, ou seja, têm o seu volume aumentado. Já a massa não se altera com o aumento da temperatura, ou seja, é esperado que o aumento da temperatura faça a densidade cair por conta da dilatação do material.
A água, entretanto, não segue essa tendência entre 0 °C e 4 °C. Isso porque a água, ao se solidificar, adota um arranjo hexagonal entre suas moléculas, o que aumenta o seu volume, tornando-se menos densa. Tal comportamento é diferente dos demais materiais, já que uma diminuição da temperatura faria o volume se comprimir, e assim ser observado um aumento da densidade.
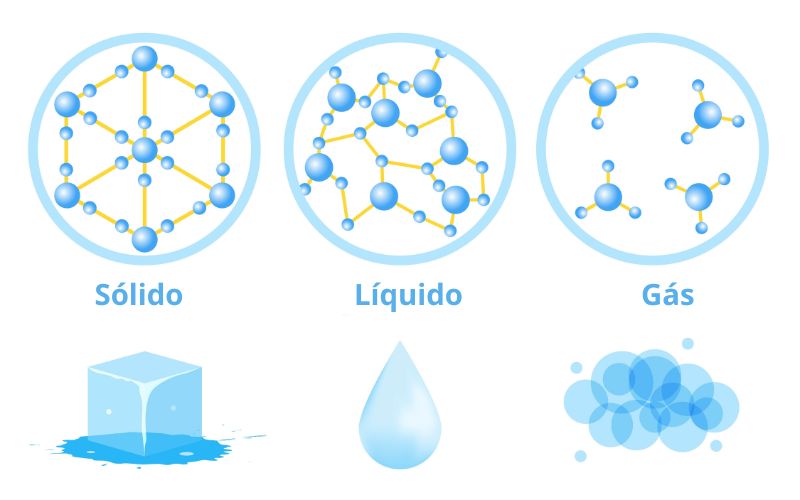
Assim sendo, a água obtém sua densidade máxima aos 4 °C (1,0 g.cm-3), tendo uma queda no seu valor ao se solidificar, conforme o gráfico a seguir demonstra:
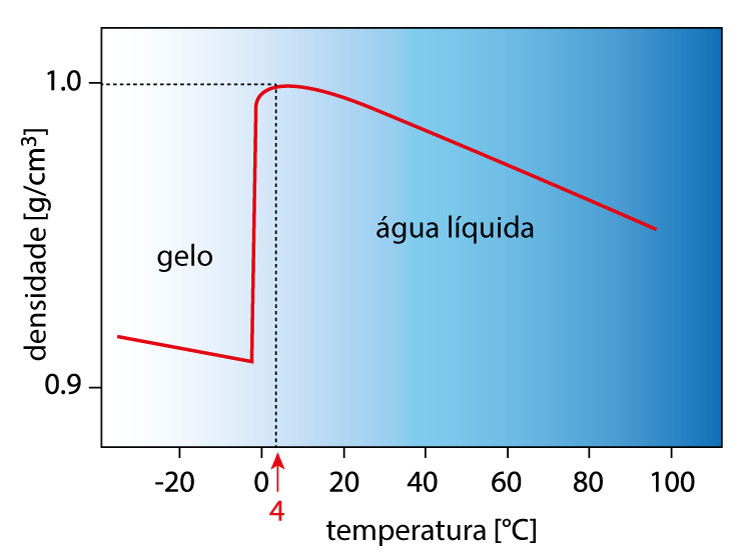
Essa anomalia é muito importante, pois permite que a água dos corpos hídricos, no inverno, congele apenas na superfície (visto que o gelo é menos denso). Assim sendo, a fauna e flora marinha são mantidas, permitindo a perpetuação da vida.

Tratando-se de misturas, a densidade também é afetada pela composição química da mistura. Ao se misturar duas substâncias, a densidade resultante é obtida por uma média ponderada entre as densidades dos participantes da substância. O sal, cloreto de sódio, possui uma densidade de 2,16 g.cm-3, enquanto a água possui uma densidade próxima de 1,0 g.cm-3. Ao se adicionar sal na água, a densidade da solução resultante aumenta. Quanto mais sal for colocado, mais próximo de 2,16 g.cm-3 será a densidade da solução resultante.
Um experimento muito simples que demonstra a dependência da composição com a densidade é a colocação de um ovo (não estragado) em água. Quando a água está pura, o ovo afunda, mas, ao se adicionar sal, o ovo flutua como consequência do aumento da densidade da solução final.

Quais são os tipos de densidade?
- Densidade absoluta: fala a respeito da densidade específica de uma substância. Muitas vezes, é sinônimo de massa específica.
- Densidade relativa: quando é mensurada em relação a algum valor de densidade de referência, geralmente a água em 4 °C. Já foi conhecida como gravidade específica.
Quais são as diferenças entre massa específica e densidade?
Embora haja muita confusão na área, pelo fato de os termos se relacionarem continuamente, massa específica e densidade não significam a mesma coisa:
- Massa específica: é entendida como a densidade absoluta de uma substância pura, ou seja, é uma grandeza específica de determinada substância. Muitas vezes, a massa específica é tabelada mediante uma temperatura de referência.
- Densidade: muitas vezes, acaba sendo utilizada como sinônimo de massa específica, mas entende-se que é melhor aplicada quando se fala da relação entre massa e volume de uma forma global, ou seja, sem relação com a composição química ou a temperatura.
Densidade de alguns materiais
A tabela a seguir lista a densidade de alguns materiais que utilizamos no cotidiano, na pressão de 1 atmosfera e 25 °C.
|
Substância |
Densidade (g.mL-1) |
|
Ar (seco) |
0,001184 |
|
Alumínio |
2,70 |
|
Cobre |
8,94 |
|
Concreto |
2,00 |
|
Lítio |
0,535 |
|
Diamante |
3,50 |
|
Ouro |
19,30 |
|
Hélio |
0,000179 |
|
Ósmio |
22,587 |
|
Irídio |
22,562 |
|
Aço |
8,05 |
|
Gelo (0 °C) |
0,917 |
|
Água (4 °C) |
1,00 |
|
Madeira |
0,70 |
O ósmio e o irídio figuram como os metais mais densos de toda a Tabela Periódica. Já o alumínio é amplamente explorado pela sua baixa densidade (quando comparado a outros metais), o que permite a criação de ligas metálicas leves.
O lítio é o metal de menor densidade da Tabela Periódica e, por isso, vem sendo empregado na confecção de baterias (as famosas íon-lítio), as quais possuem um bom rendimento e permitem a produção de materiais eletrônicos e carros mais leves.
O hélio é um gás menos denso que o ar e, por ser inerte (ou seja, não entra em combustão, por exemplo), é ideal para preencher balões (seja de festas ou até mesmo meteorológicos).
Veja também: Como comparar a densidade dos elementos químicos da Tabela Periódica?
Exercícios resolvidos sobre densidade
Questão 1
A densidade é uma propriedade que relaciona massa e volume de um material. Um estudante iniciou um procedimento de determinação da densidade de uma amostra sólida desconhecida. Primeiro ele determinou a massa da amostra, obtendo 27,8 g. Em seguida, utilizou uma proveta, graduada em mililitro, com água para determinar o volume da amostra, conforme esquematizado na figura. Considere a densidade da água igual a 1 g/mL.
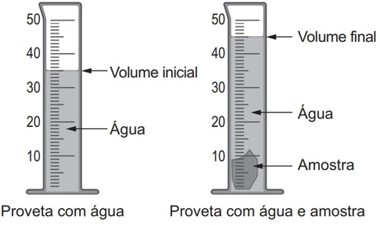
A densidade da amostra obtida, em g/mL, é mais próxima de
A) 0,36.
B) 0,56.
C) 0,62.
D) 0,79.
E) 2,78.
Resolução:
Alternativa E
Antes de inserir o objeto, o volume era de 35 mL, conforme é possível ver na imagem da proveta com água. Ao se inserir a amostra, o volume foi deslocado para 45 mL, o que nos permite concluir que o volume da amostra é de 10 mL (45 – 35).
Sendo a massa do objeto igual a 27,8 g, temos, então, para a densidade:
\(d=\frac{27,8}{10}=2,78g.mL^{-1}\)
Questão 2
(Enem) Em um experimento, foram separados três recipientes A, B e C, contendo 200 ml de líquidos distintos: o recipiente A continha água, com densidade de 1,00 g/ml; o recipiente B, álcool etílico, com densidade de 0,79 g/ml; e o recipiente C, clorofórmio, com densidade de 1,48 g/ml. Em cada um desses recipientes foi adicionada uma pedra de gelo, com densidade próxima a 0,90 g/ml.
No experimento apresentado, observou-se que a pedra de gelo:
A) Flutuou em A, flutuou em B e flutuou em C.
B) Flutuou em A, afundou em B e flutuou em C.
C) Afundou em A, afundou em B e flutuou em C.
D) Afundou em A, flutuou em B e afundou em C.
E) Flutuou e A, afundou em B e afundou em C.
Resolução:
Alternativa B
O gelo, de densidade 0,90 g/ml, flutuará em líquidos mais densos que ele (A, água e C, clorofórmio) e afundará em líquidos menos densos que ele (B, álcool etílico).