Distribuição eletrônica
A distribuição eletrônica é uma forma de se determinar a configuração eletrônica do átomo. Segue dois princípios: o da exclusão de Pauli e o da construção (aufbau).
Por Stéfano Araújo Novais
PUBLICIDADE
A distribuição eletrônica é um método para determinar a configuração eletrônica do átomo, dispondo os elétrons nas camadas eletrônicas, ou em seus orbitais atômicos. A distribuição eletrônica segue dois princípios, o da exclusão de Pauli, que determina que apenas dois elétrons podem ocupar um orbital atômico, e o da construção, também conhecido como aufbau, que determina que os elétrons devem sempre ocupar o menor nível de energia possível.
A distribuição eletrônica, quando feita por subníveis, deve utilizar ferramentas como o Diagrama de Pauling, o qual consegue dispor os orbitais atômicos em ordem crescente de energia, respeitando-se o princípio da construção. A distribuição eletrônica também está diretamente relacionada com a Tabela Periódica, podendo dividir os elementos presentes na tabela de acordo com a configuração eletrônica deles.
Leia também: Números quânticos — valores que descrevem algumas propriedades dos orbitais atômicos
Resumo sobre distribuição eletrônica
- A distribuição eletrônica é um método para determinar a configuração eletrônica de um átomo.
- Nesse método, os elétrons são dispostos nas camadas eletrônicas dos átomos ou em seus subníveis.
- A distribuição eletrônica segue dois princípios, o da exclusão de Pauli e o da construção, conhecido como aufbau.
- Para se fazer a distribuição eletrônica por subníveis, recomenda-se a utilização do Diagrama de Pauling, que apresenta os orbitais atômicos em nível crescente de energia.
- A configuração eletrônica é importante, pois serve para determinar propriedades químicas dos átomos.
Videoaula sobre distribuição eletrônica
O que é distribuição eletrônica?
A distribuição eletrônica é uma metodologia utilizada para se determinar a configuração eletrônica de um átomo. Por meio dela, é possível listar todos os elétrons de um átomo, dispostos nas camadas eletrônicas existentes. A configuração eletrônica de um átomo é importante para se determinar as propriedades químicas de um átomo e, por isso, é preciso realizar a distribuição eletrônica e, assim, descrever a eletrosfera.
Como fazer distribuição eletrônica?
A distribuição eletrônica segue dois princípios, o da exclusão de Pauli e o da construção, conhecido como aufbau.
→ Princípio da exclusão de Pauli
Para os átomos conhecidos até então, são possíveis até sete camadas eletrônicas, conhecidas pelas letras K, L, M, N, O, P e Q. Tais camadas são compostas pela combinação de orbitais atômicos, regiões de alta probabilidade de se encontrar elétrons.
Tais orbitais são identificados pelas letras s, p, d e f, também comumente chamados de subníveis. A mecânica quântica demonstrou que só existe um tipo de orbital s, enquanto existem três formas de orbitais p, cinco formas de orbitais d e sete formas de orbitais f.
Quando um átomo está em seu estado fundamental, os elétrons ocupam todos os níveis possíveis, a fim de tornar a energia do átomo a menor possível. Contudo, o cientista Wolfgang Pauli, por meio de algo conhecido como princípio da exclusão de Pauli, determinou regras para a distribuição eletrônica. Segundo Pauli, cada orbital pode alojar, no máximo, dois elétrons. Assim sendo, o número máximo por orbitais é:
|
Tipo de orbital |
Número máximo de elétrons |
|
s |
2 |
|
p |
6 |
|
d |
10 |
|
f |
14 |
Ou seja, para uma camada composta apenas por um orbital s, o número máximo de elétrons que podem estar presentes nesta é igual a 2. Contudo, se a camada eletrônica for composta por orbitais s e p, o número máximo de elétrons que ela pode comportar é igual a 8 (2 elétrons no orbital s mais 6 elétrons nos orbitais p). Avaliações experimentais demonstraram que as camadas conhecidas são compostas dos seguintes orbitais:
|
Camada eletrônica |
Orbitais presentes |
Número máximo de elétrons |
|
K |
s |
2 |
|
L |
s e p |
2 + 6 = 8 |
|
M |
s, p e d |
2 + 6 + 10 = 18 |
|
N |
s, p, d e f |
2 + 6 + 10 + 14 = 32 |
|
O |
s, p, d e f |
2 + 6 + 10 + 14 = 32 |
|
P |
s, p e d |
2 + 6 + 10 = 18 |
|
Q |
s e p |
2 + 6 = 8 |
O princípio da exclusão de Pauli ajuda a entender, portanto, porque todos os elétrons de um átomo não se alojam, por exemplo, na camada K, embora essa tenha a menor energia, visto que está mais próxima do núcleo e possui menor energia potencial.
→ Princípio da construção ou aufbau
Outro princípio que nos permite fazer uma distribuição eletrônica é o chamado princípio da construção, ou princípio aufbau, palavra alemã que significa “construção”. Em resumo, esse princípio determina que os elétrons devem ser dispostos no átomo com a menor energia possível. Assim sendo, um átomo só ocupará um orbital de maior energia se o orbital imediatamente anterior (em termos energéticos) já estiver totalmente preenchido.
A energia dos orbitais não depende apenas da distância em relação ao núcleo (energia potencial), mas também de parâmetros angulares. Isso gera uma consequência interessante: é possível que orbitais de camadas mais externas, ou seja, mais distantes do núcleo, possuam menor energia que orbitais de camadas mais internas.
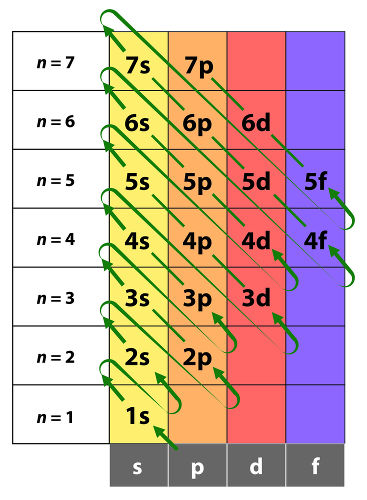
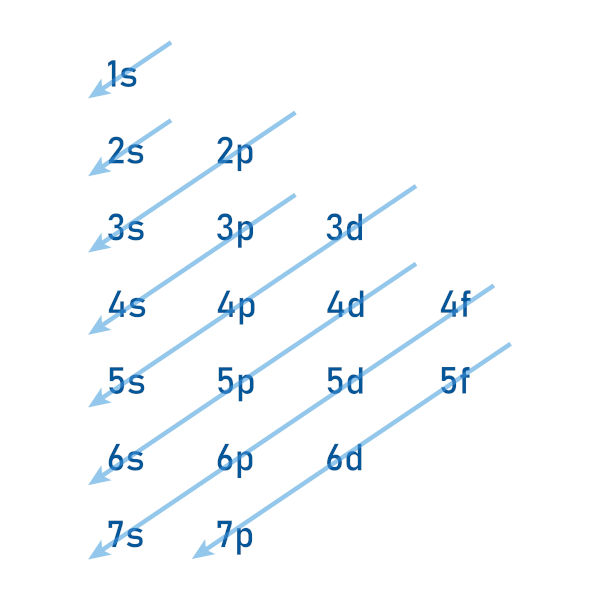
O cientista Linus Pauling foi responsável pela criação de um diagrama, o qual dispõe os orbitais atômicos em ordem crescente de energia, dando a ordenação adequada dos orbitais de acordo com o princípio de aufbau, sanando um grande problema.
Para a construção desse diagrama, Pauling utilizou os números de 1 até 7 para identificar as sete camadas eletrônicas existentes. Ao lado de cada numeral, aparece a letra correspondente ao subnível. Assim sendo, por exemplo, ao se ler “3p”, devemos entender que estamos referenciando o orbital p da terceira camada eletrônica, que é a camada M.
|
Camada eletrônica |
Composição em termos de orbitais |
|
K |
1s |
|
L |
2s e 2p |
|
M |
3s, 3p e 3d |
|
N |
4s, 4p, 4d e 4f |
|
O |
5s, 5p, 5d e 5f |
|
P |
6s, 6p e 6d |
|
Q |
7s e 7p |
Por isso, ao distribuir elétrons utilizando orbitais, devemos observar o diagrama de Pauling para não errarmos a ordem energética dos subníveis.
Veja também: Como se faz a distribuição eletrônica em íons?
Distribuição eletrônica em camadas
Em níveis iniciais da compreensão da Química e da eletrosfera, é comum fazer apenas a distribuição dos elétrons de acordo com as camadas eletrônicas. É sabido, experimentalmente, que o número máximo de elétrons suportados por camada é:
|
Camada eletrônica |
Número máximo de elétrons |
|
K |
2 |
|
L |
8 |
|
M |
18 |
|
N |
32 |
|
O |
32 |
|
P |
18 |
|
Q |
8 |
Portanto, podemos distribuir os elétrons de um átomo da seguinte forma: por exemplo, façamos a distribuição eletrônica em camadas dos elétrons presentes no átomo de enxofre, S, que possui número atômico (Z) igual a 16.
Se Z é igual a 16 para o átomo de enxofre, então o número de prótons é igual a 16. Todo átomo é uma espécie eletricamente neutra e, assim sendo, o número de prótons é igual ao número de elétrons. Por isso, o átomo de enxofre em questão possui, também, 16 elétrons. Dispondo-se os 16 elétrons em ordem energética das camadas, temos, para o átomo de enxofre:
K = 2; L = 8; M = 6
Ou seja, dos 16 elétrons presentes no átomo de enxofre, 2 estão na camada K, 8 estão na camada L e 6 estão na camada M.
Contudo, a distribuição eletrônica por camadas possui algumas limitações da real compreensão da estrutura eletrônica do átomo. Vejamos, por exemplo, o átomo de cálcio, Ca, cujo número atômico é igual a 20.
Pelas mesmas questões do átomo de enxofre, o átomo de cálcio possui 20 prótons e, portanto, 20 elétrons. A distribuição eletrônica esperada seria:
K = 2; L = 8; M = 10
Contudo, experimentalmente, é sabido que a distribuição do cálcio é:
K = 2; L = 8; M = 8; N = 2
Esse fato, em princípio, parece distorcer o princípio de aufbau. Contudo, o cálcio é um exemplo de átomo cuja configuração eletrônica real só poderá ser realizada caso a distribuição eletrônica leve em consideração o diagrama de Linus Pauling.
Diagrama de Linus Pauling
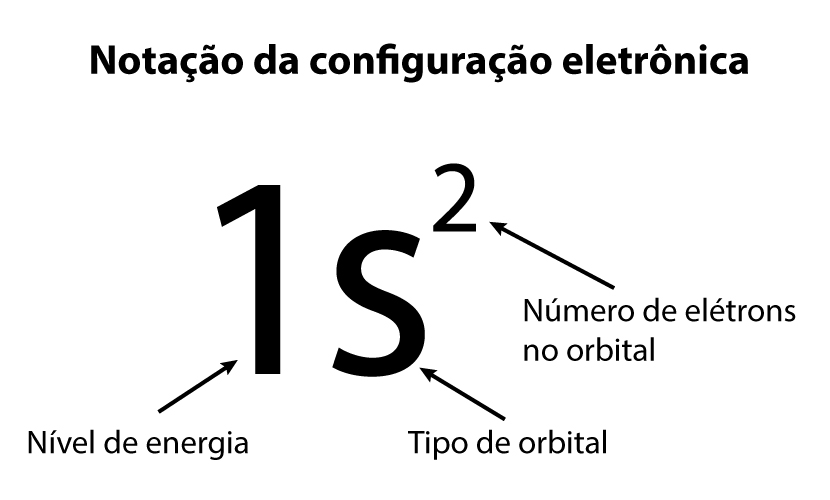
O diagrama de Linus Pauling apresenta uma forma mais adequada para a distribuição eletrônica dos átomos. Nessa metodologia, o número de elétrons presente em cada orbital deve ser representado por um número em cima e à direita da letra que representa o orbital. Assim sendo, se estão presentes cinco elétrons em um orbital d do sexto nível, devemos escrever na forma “6d5”.
Voltando à situação do cálcio, que vimos anteriormente que possui 20 elétrons, é possível perceber que a sua distribuição eletrônica, de acordo com o diagrama de Pauling é:
1s2 2s2 2p6 3s2 3p6 4s2
Ou seja, dos 20 elétrons presentes no átomo de cálcio, 2 estão na camada K, 8 estão na camada L, 8 estão na camada M e 2 estão na camada N.
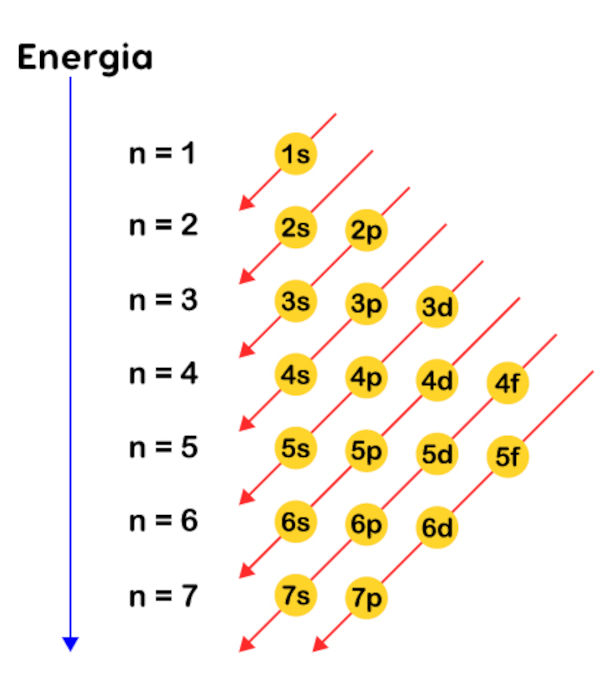
No diagrama, seguem-se as setas diagonais para a ordem correta dos orbitais em termos de energia. Perceba que a camada M é composta por três subníveis: 3s, 3p e 3d. Contudo, o orbital 4s, o primeiro da camada N, apesar de estar mais distante do núcleo, apresenta uma energia total inferior ao orbital 3d e, portanto, segundo o princípio de aufbau, recebe elétrons antes do orbital 3d.
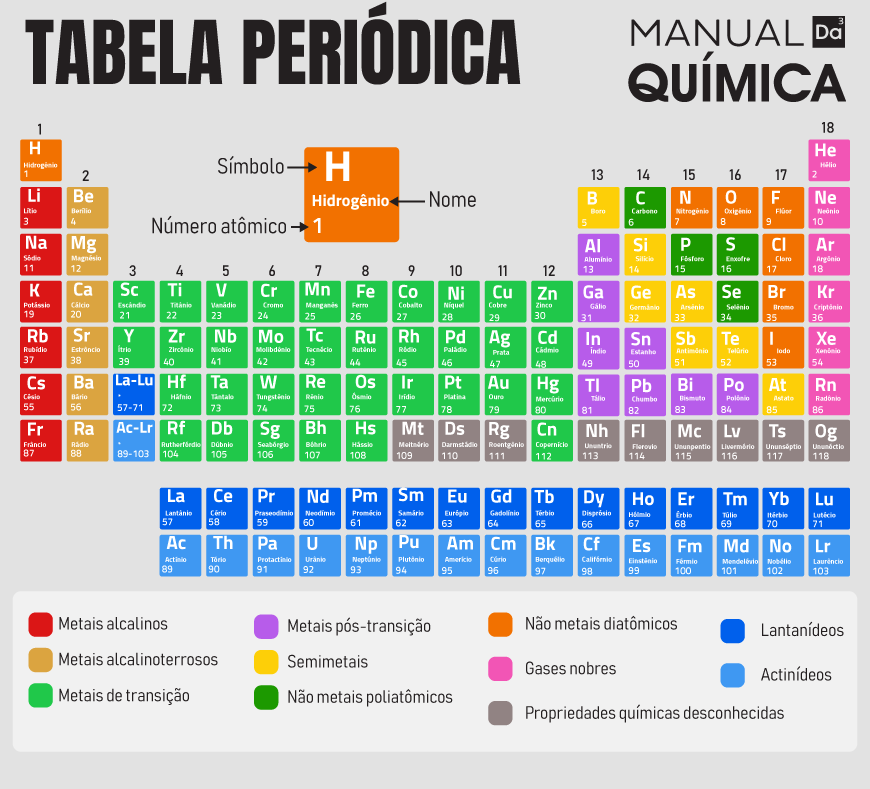
Distribuição eletrônica na Tabela Periódica
A configuração eletrônica determina propriedades químicas dos átomos. Por isso, átomos de um mesmo grupo da Tabela Periódica apresentam igualdade na quantidade de elétrons presentes em sua camada eletrônica mais externa, conhecida como camada de valência.
Outro ponto importante é que a Tabela Periódica aproxima elementos que possuem o mesmo orbital de maior energia, como é possível ver a seguir:
- Bloco s: composto por elementos dos grupos 1 (s1) e 2 (s2), pois possuem o orbital s como subnível de maior energia.
- Bloco p: composto por elementos dos grupos 13 até 18 (p1 até p6), pois possuem o orbital p como subnível de maior energia.
- Bloco d: composto por elementos dos grupos 3 até 12 (d1 até d10), pois possuem o orbital d como subnível de maior energia.
- Bloco f: composto por elementos presentes nas séries dos lantanídeos e actinídeos (f1 até f14), pois possuem o orbital f como subnível de maior energia.
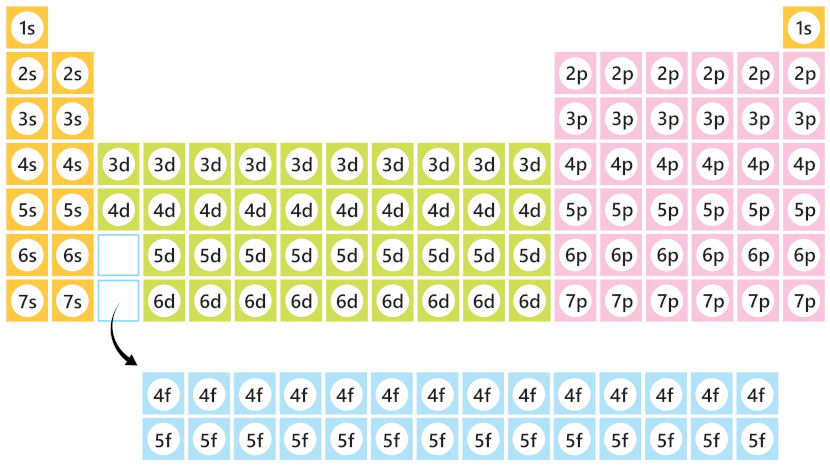
A divisão da Tabela Periódica em blocos de distribuição eletrônica também auxilia na localização desses elementos na própria tabela por meio da configuração eletrônica. É sabido que o período é numericamente igual ao número de camadas eletrônicas de um átomo. Assim sendo, um elemento no terceiro período possui três camadas eletrônicas (K, L e M). Por isso, a camada mais externa do átomo ajuda a localizar o elemento na Tabela Periódica.
Por exemplo, vejamos o caso do bromo (Br, Z = 35). Possuindo 35 elétrons (pois tem 35 prótons), o bromo possui a seguinte distribuição eletrônica:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Como a camada mais externa é a de número 4, podemos dizer que o bromo se encontra no quarto período da Tabela Periódica. Além disso, o orbital de maior energia é o p, assim sendo ele se encontra no bloco p, que contempla os grupos 13, 14, 15, 16, 17 e 18. Possuindo cinco elétrons no orbital 4p, é possível dizer, portanto, que o bromo pertence ao grupo 17, pois se os elementos do grupo 18 são do tipo p6, então p5, possuindo 1 elétron a menos, pertence ao grupo 17.
Saiba mais: Como é feita a classificação dos elementos na Tabela Periódica?
Exercícios resolvidos sobre distribuição eletrônica
Questão 1
(UECE 1ª Fase/2024.1) Efetuou-se a configuração eletrônica, em seu estado fundamental, de determinado elemento químico, cujos dados foram: nível 1 = completo; nível 2 = completo; nível 3 = completo; nível 4 = 18 elétrons; nível 5 = 6 elétrons.
Assim, é correto afirmar que esse elemento químico é o:
- Sn (Z = 50).
- Sb (Z = 51).
- Te (Z = 52).
- I (Z = 53).
Resposta: Letra C.
Como o átomo estava em seu estado fundamental, é possível afirmar que há eletroneutralidade, ou seja, o número de elétrons é igual ao número de prótons (que é o número atômico). Pela configuração informada, os três primeiros níveis estão completos, ou seja, com 2, 8 e 18 elétrons, respectivamente, totalizando 28 elétrons. Além disso, há mais 18 elétrons no nível 4 e mais 6 elétrons no nível 5. Dessa forma, o total é de 52 elétrons. Assim sendo, essa espécie possui também 52 prótons e, por isso, pode-se afirmar que é o telúrio, Te.
Questão 2
(Unicentro 2023) Dificilmente o cobalto é encontrado de forma pura na natureza, pois ele reage facilmente com oxigênio e cloreto, normalmente encontrado em cobaltita e eritrita. É utilizado para diversas finalidades, entre elas, as ligas metálicas usadas em pás (hélices) de turbinas a gás, turbinas de aviões, como também em ímãs ou em cintas magnéticas. Representado pelo símbolo Co, esse elemento possui massa de 59 u e 32 nêutrons.
Assinale a alternativa que apresenta, corretamente, o número de elétrons do cobalto e sua respectiva distribuição eletrônica no estado fundamental.
- 1s2 2s2 2p6 3s2 3p6 4s2 3d7
- 1s2 2s2 2p6 3s2 3p6 4s2 3d10
- 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
- 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 5s2 4d9
- 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3
Resposta: Letra A.
Possuindo massa de 59 u e 32 nêutrons, é possível determinar o número atômico do cobalto pela fórmula A = Z + n, em que A é a massa, Z é o número atômico e n é o número de nêutrons.
59 = Z + 32
Z = 27
Com isso, chegamos à conclusão que o cobalto possui Z = 27, ou seja, 27 prótons. Como está no estado fundamental, o número de elétrons é igual ao número de prótons e, portanto, também há 27 elétrons.
A distribuição dos 27 elétrons, seguindo o diagrama de Pauling, é 1s2 2s2 2p6 3s2 3p6 4s2 3d7.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: https://goldbook.iupac.org/