Fórmulas Químicas
As principais fórmulas químicas que representam os elementos e o número de átomos das ligações que compõem as moléculas são: molecular, eletrônica e estrutural.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
As fórmulas químicas foram criadas para facilitar a representação da composição das substâncias. Por meio delas podemos discernir a quantidade e os tipos de átomos que formam a substância.
Existem vários tipos de fórmulas químicas, que variam inclusive conforme o tipo de ligação. Mas aqui trataremos das principais fórmulas químicas usadas para representar os compostos moleculares, que são aqueles formados unicamente por ligações covalentes. Quando átomos de dois elementos ligam-se por meio desse tipo de ligação, eles realizam um compartilhamento de pares de elétrons. Assim, a primeira fórmula que é usada para representar as ligações covalentes é uma que mostra os elementos, o número deles e também os pares de elétrons compartilhados. Essa é a fórmula eletrônica ou fórmula de Lewis.
Na fórmula eletrônica, os elétrons da última camada eletrônica (camada de valência) de cada átomo são mostrados por meio de “pontinhos” ou “x” ao redor do símbolo do elemento. Por exemplo, o hidrogênio é da família 1, então ele possui um elétron em sua camada de valência. Já o oxigênio é da família 16 ou VI-A, logo possui seis elétrons na sua camada de valência:
![]()
Elétrons na camada de valência do hidrogênio e oxigênio
Então, segundo a regra do octeto, o hidrogênio precisa de mais um elétron para ficar estável (como ele só possui uma camada eletrônica, esse elemento fica estável com apenas dois elétrons). Já o oxigênio precisa de mais dois para ficar com oito elétrons e, assim, ficar estável. Logo, dois átomos de H ligam-se a um átomo de O, realizando dois compartilhamentos de elétrons, isto é, duas ligações covalentes:
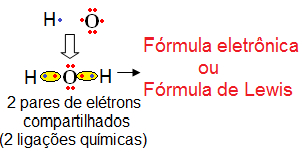
Fórmula de Lewis da água
Observe que na fórmula de Lewis os pares de elétrons compartilhados são representados por uma espécie de “laço” em volta deles, que mostra essa formação das ligações. Quando ocorre como no caso acima, que entre dois átomos existe apenas uma ligação, então temos uma ligação simples. Se houver entre dois átomos duas ligações, será uma ligação dupla, e se forem três ligações, então será uma ligação tripla. Observe isso abaixo:
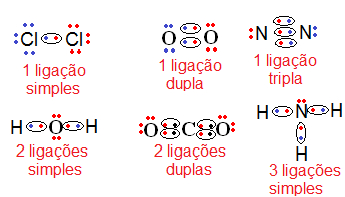
Exemplos de ligações covalentes simples, duplas e triplas
Agora vejamos outro tipo de fórmula química mais simples que a fórmula eletrônica: a fórmula estrutural plana. Essa fórmula também mostra os elementos e o número de átomos envolvidos, mas a diferença é que o par de elétrons compartilhado é simbolizado por um traço (—). Veja:

Traços usados na fórmula estrutural
Veja alguns exemplos:
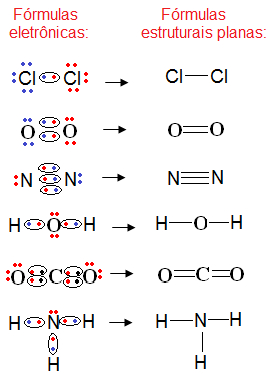
Exemplos de fórmulas estruturais planas
Uma fórmula química bastante simples de se escrever é a fórmula molecular. Essa fórmula indica o número real de átomos de cada tipo de elemento químico que aparece na molécula.
Veja como fica a fórmula molecular para os compostos mencionados nos exemplos anteriores:
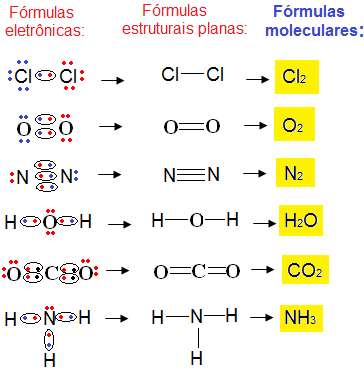
Exemplos de fórmulas moleculares
Por Jennifer Fogaça
Graduada em Química
Videoaulas relacionadas: