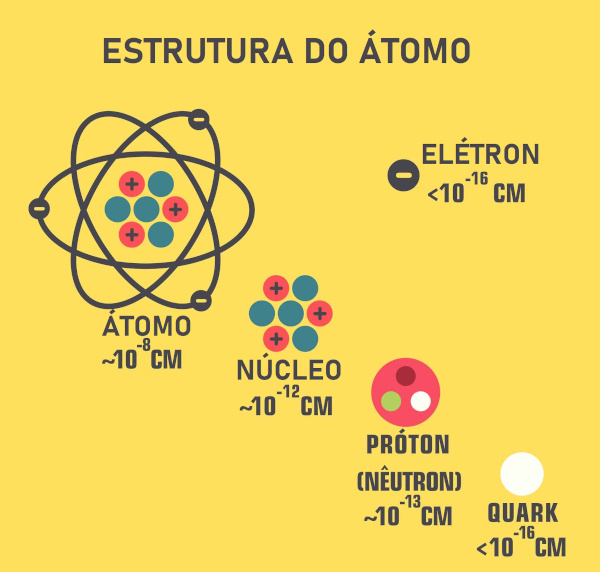
Isótopos
Isótopos são variantes de um mesmo elemento químico. Possuem o mesmo número de prótons, mas diferentes números de nêutrons.
Por Jhonilson Pereira Gonçalves
PUBLICIDADE
Os isótopos são variantes de um mesmo elemento químico que apresentam o mesmo número de prótons no núcleo, mas diferem no número de nêutrons. Nesse sentido, essa variação resulta em diferentes massas atômicas para um mesmo elemento, gerando uma diversidade de formas para um único elemento na natureza. Essas variações isotópicas permitem diferentes propriedades físicas e químicas, afetando desde a estabilidade dos átomos até suas aplicações práticas em diversas áreas científicas e tecnológicas.
A descoberta e a compreensão dos isótopos revolucionaram a Química moderna, ampliando nossa percepção sobre a estrutura atômica e fornecendo ferramentas cruciais em várias disciplinas. A capacidade de identificar e utilizar isótopos desempenha um papel fundamental em campos como datação arqueológica, energia nuclear, medicina diagnóstica e até mesmo na investigação de processos geológicos e astrofísicos.
Leia também: Isomeria — fenômeno em que compostos possuem a mesma fórmula molecular, mas são moléculas diferentes
Resumo sobre os isótopos
- Os isótopos são variantes de um mesmo elemento químico. Possuem o mesmo número de prótons, mas diferentes números de nêutrons.
- São identificados pelo nome ou símbolo do elemento seguido pelo número de massa — a soma de prótons e nêutrons.
- Devido às variações no número de nêutrons, os isótopos apresentam diferentes massas atômicas para um mesmo elemento.
- Podem ser estáveis ou radioativos. Sendo assim, isótopos estáveis não sofrem decaimento radioativo, enquanto isótopos radioativos passam por desintegração para alcançar estabilidade.
- Têm aplicações em datação arqueológica, medicina nuclear, geração de energia nuclear, entre outras áreas científicas e tecnológicas.
- A natureza oferece uma ampla variedade de isótopos para muitos elementos na Tabela Periódica.
- Estudá-los ajuda a compreender a estrutura atômica, a evolução de materiais e processos naturais, além de ser fundamental para diversos avanços tecnológicos.
O que são isótopos?
Isótopos são átomos de um mesmo elemento químico, ou seja, possuem idênticos números de prótons, porém diferentes números de massa. Isso acontece porque os números de nêutrons em seus núcleos atômicos são distintos, uma vez que a massa atômica consiste na soma dos prótons e nêutrons presentes no núcleo do átomo. Dessa forma, os isótopos são uma variação de um mesmo elemento, podendo ser estável ou não.
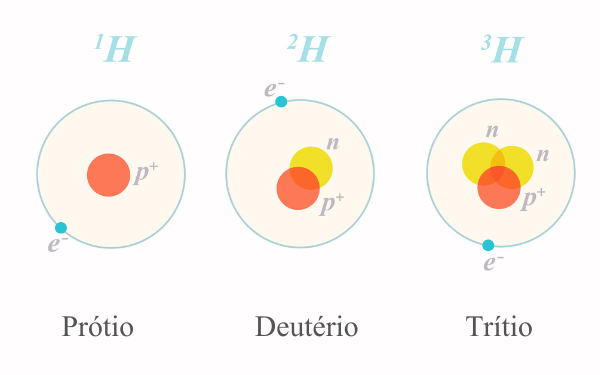
Por exemplo, o hidrogênio possui três isótopos principais:
- o hidrogênio comum, também chamado de prótio, tem um próton e nenhum nêutron;
- o deutério, que tem um próton e um nêutron;
- o trítio, que tem um próton e dois nêutrons.
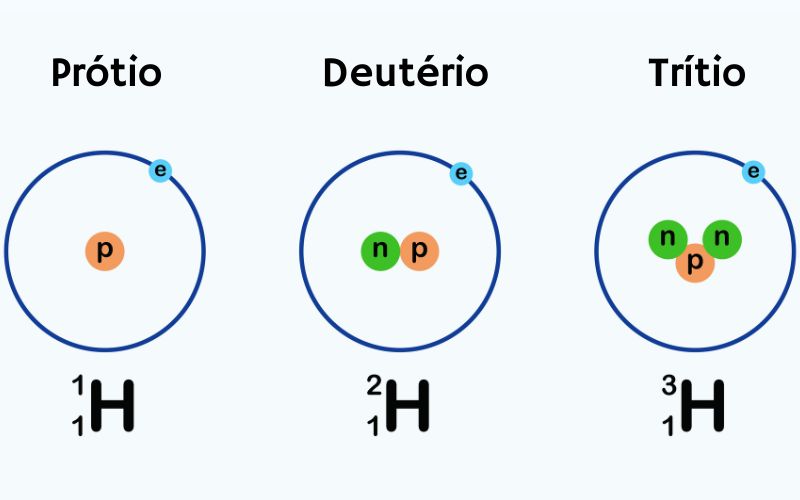
Essas variações nos isótopos podem influenciar propriedades físicas, como a estabilidade do núcleo atômico, e químicas, como a reatividade do elemento. Diante disso, alguns isótopos são estáveis, enquanto outros são radioativos, passando por decaimento nuclear ao longo do tempo para alcançar uma forma mais estável. Sobre isso, faremos uma abordagem no tópico a seguir.
Tipos de isótopos
Os isótopos podem ser classificados de acordo com sua natureza (estabilidade) em isótopos estáveis e isótopos radioativos.
→ Isótopos estáveis
Isótopos estáveis são isótopos que não mudam com o tempo, mantendo-se constantes e não sofrendo decaimento radioativo. Por exemplo, o carbono-12 (C12) e o oxigênio-16 (O16) são isótopos estáveis comuns.
→ Isótopos radioativos
Isótopos radioativos são isótopos instáveis e se decompõem ao longo do tempo, liberando energia ou partículas. O carbono-14 (C14) é um exemplo de isótopo radioativo, usado na datação de materiais antigos. Nesse contexto, para fins de comparação, podemos ver na figura a seguir a composição atômica dos três isótopos de carbono.
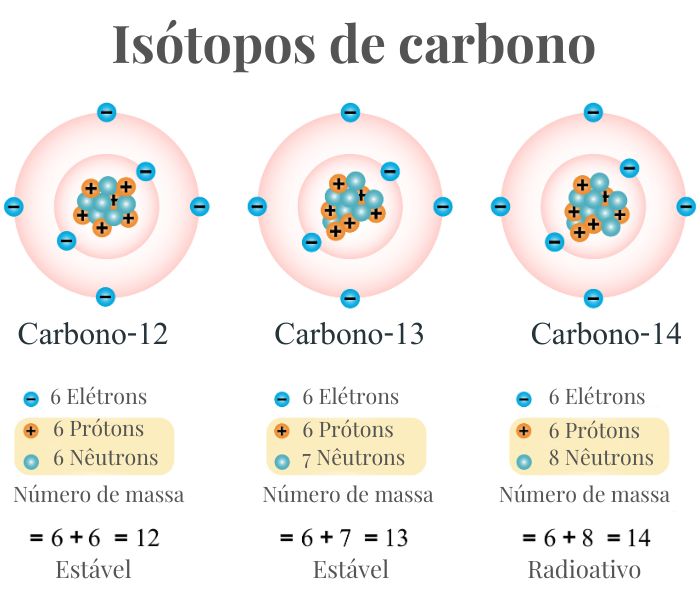
Vale destacar que o decaimento do carbono-14 é um processo radioativo conhecido como “decaimento beta”. Por isso o carbono-14 é considerado um isótopo radioativo do carbono, pois ele sofre decaimento em nitrogênio-14 por meio da emissão de uma partícula beta (β) — um elétron — e uma antineutrino.
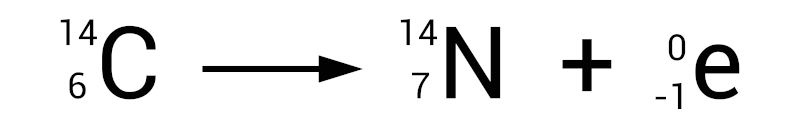
Para compreendermos melhor como esse processo ocorre, podemos resumi-lo da seguinte maneira:
- Um nêutron no núcleo do carbono-14 se transforma em um próton.
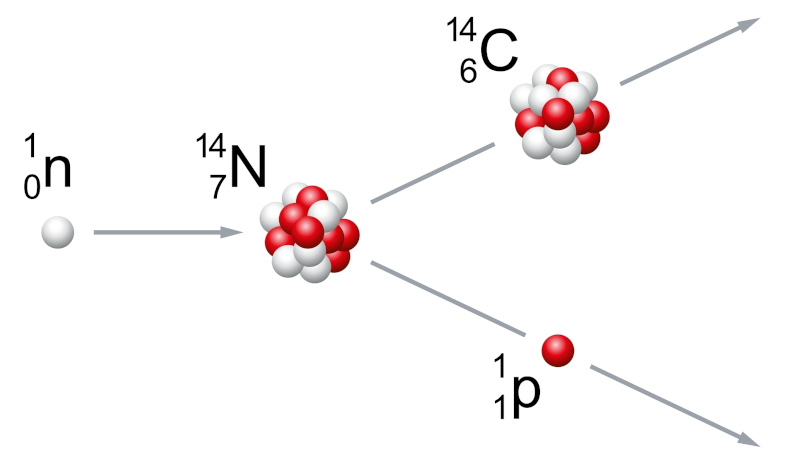
- Durante essa transformação, uma partícula beta (um elétron) é emitida do núcleo do átomo de carbono-14.

Esse processo de decaimento beta reduz o número de nêutrons no núcleo, convertendo um átomo de carbono-14 em um átomo de nitrogênio-14.
Diante disso, é esse decaimento que é utilizado em datação por radiocarbono para determinar a idade de materiais orgânicos, pois a taxa de decaimento do carbono-14 é conhecida e pode ser usada para estimar quanto tempo se passou desde a morte do organismo.
Importante: Os isótopos artificiais são os isótopos criados artificialmente em laboratórios por meio de reações nucleares. Um exemplo é o amerício-241 (241Am), usado em dispositivos de detecção de fumaça.

O dispositivo contém uma pequena quantidade de AmO2 em uma câmara fechada. Dessa forma, o amerício-241 emite partículas alfa, que ionizam o ar dentro da câmara. Assim, quando a fumaça entra na câmara, ela absorve as partículas alfa, interrompendo o processo de ionização do ar.
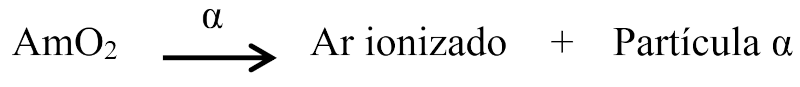
Nomenclatura dos isótopos
O padrão na nomenclatura dos isótopos é bem simples, para isso, basta seguir o nome ou símbolo do elemento químico (como H para hidrogênio, O para oxigênio, U para urânio, C para carbono), seguido pelo número de massa, que indica a soma do número de prótons e nêutrons no núcleo do átomo. Essa convenção facilita a identificação e diferenciação entre diferentes isótopos do mesmo elemento. Veja exemplos a seguir.
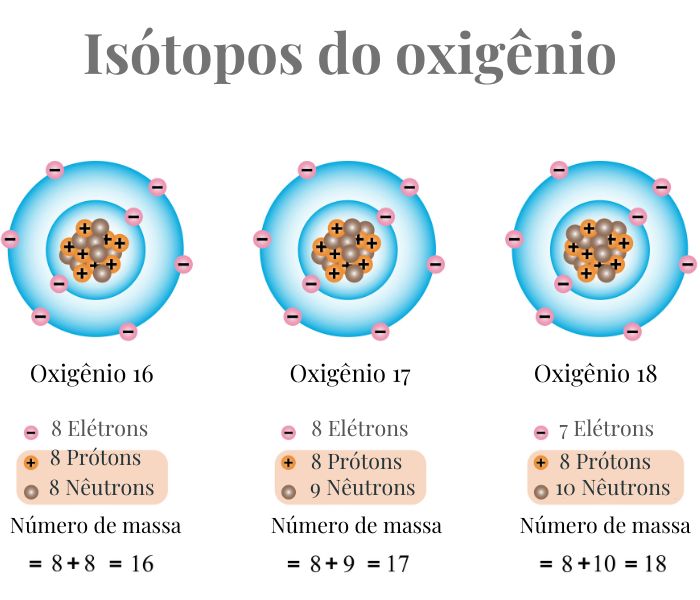
- Oxigênio:
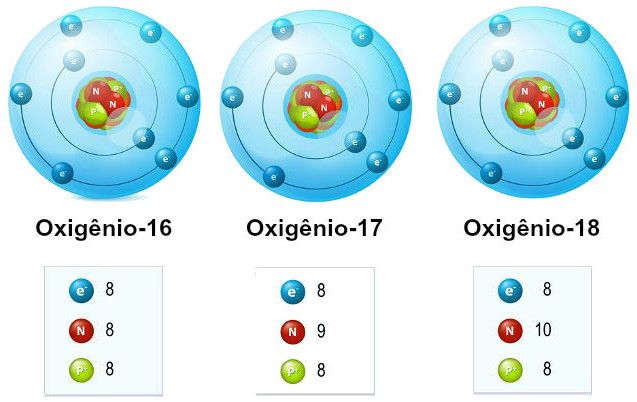
- Oxigênio-16 (16O) é o isótopo mais comum do oxigênio, com 8 prótons e 8 nêutrons.
- Oxigênio-17 (17O) tem 8 prótons e 9 nêutrons.
- Oxigênio-18 (18O) tem 8 prótons e 10 nêutrons.
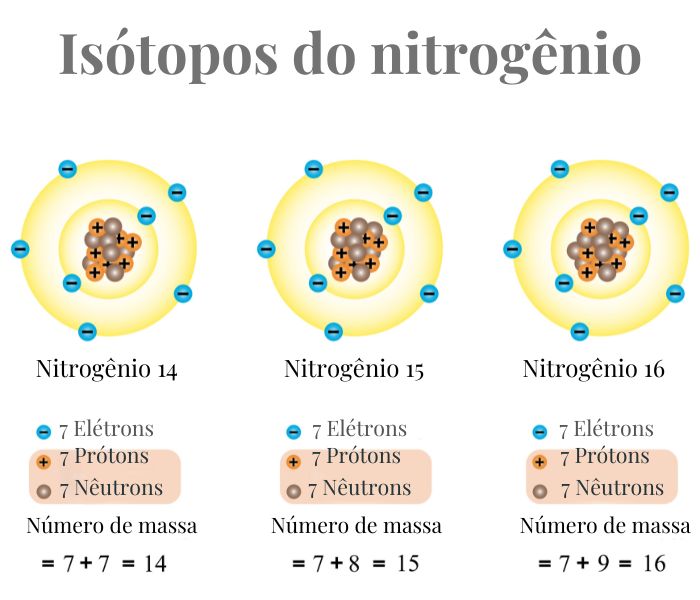
- Nitrogênio:
- Nitrogênio-14 (14N) tem 7 prótons e 7 nêutrons.
- Nitrogênio-15 (15N) tem 7 prótons e 8 nêutrons.
- Nitrogênio-16 (16N) tem 7 prótons e 8 nêutrons.
Desse modo, sempre que formos nos referir a isótopos, devemos seguir esse padrão de escrita para facilitar a compreensão.
Tabela dos isótopos
Aqui são apresentados isótopos de alguns dos elementos da Tabela Periódica (organização sistematizada das espécies atômicas).
|
Elemento |
Isótopos estáveis |
|
Hidrogênio |
Hidrogênio-1 (1H), Deutério (2H), Trítio (3H) |
|
Hélio |
Hélio-3 (3He), Hélio-4 (4He) |
|
Lítio |
Lítio-6 (6Li), Lítio-7 (7Li) |
|
Carbono |
Carbono-12 (12C), Carbono-13 (13C) |
|
Nitrogênio |
Nitrogênio-14 (14N) |
|
Oxigênio |
Oxigênio-16 (16O), Oxigênio-17 (17O), Oxigênio-18 (18O) |
|
Flúor |
Flúor-19 (19F) |
|
Sódio |
Sódio-23 (23Na) |
|
Magnésio |
Magnésio-24 (24Mg), Magnésio-25 (25Mg), Magnésio-26 (26Mg) |
|
Fósforo |
Fósforo-31 (31P) |
|
Enxofre |
Enxofre-32 (32S), Enxofre-33 (33S), Enxofre-34 (34S), Enxofre-36 (36S). |
|
Cloro |
Cloro-35 (35Cl), Cloro-37 (37Cl) |
|
Potássio |
Potássio-39 (39K), Potássio-41 (41K) |
Isótopos, isóbaros e isótonos
Além dos isótopos, existem os isótonos e isóbaros, oriundos da emissão de outras partículas do núcleo atômico. Dessa forma, para fins de diferenciação, temos:
|
Propriedade |
Isótopo |
Isóbaro |
Isótono |
|
Definição |
Átomos com mesmo número de prótons, mas diferentes números de massa. |
Átomos com o mesmo número de massa, mas com diferentes números de prótons. |
Átomos de diferentes elementos com mesmo número de nêutrons. |
|
Exemplo |
12C e 14C |
40K e 40Ca |
15N e 16O |
|
Partículas iguais |
Mesmo número atômico (prótons). |
Mesmo número de massa (soma de prótons e nêutrons). |
Mesmo número de nêutrons. |
|
Partículas diferentes |
Diferente número de nêutrons. |
Diferente número de prótons. |
Diferente número de prótons (nº atômico). |
Sendo assim, para facilitar o entendimento, lembre-se do seguinte macete:
- Isótopos: “p” de “prótons” — são átomos com o mesmo número de prótons, mas que diferem no número de massa.
- Isóbaros: “a” faz referência ao “A”, símbolo da massa atômica — são átomos que têm o mesmo número de massa (A), mas que diferem no número atômico, ou seja, são elementos diferentes.
- Isótonos: “n” de “nêutrons” — são átomos que têm o mesmo número de nêutrons, mas diferem no número prótons e, consequentemente, na massa.
Por fim, percebe-se o quão importante é conhecer essas variações atômicas dos elementos, pois, além de saber diferenciá-los, devemos levar em consideração suas aplicações, uma vez que essas variantes isotópicas possibilitam a datação de fósseis, a investigação de reações químicas e processos naturais, a geração de energia em reatores nucleares, bem como aplicações médicas em exames de imagem e terapias.
Nesse sentido, a compreensão dos isótopos permite uma visão mais aprofundada da composição e do comportamento dos elementos químicos, contribuindo significativamente para o avanço do conhecimento científico e tecnológico. Para saber mais detalhes sobre as semelhanças atômicas, clique aqui.
Exercícios resolvidos sobre os isótopos
Questão 1
(UFPA) Os isótopos do hidrogênio recebem os nomes de prótio (1H1), deutério (1H2) e trítio (1H3). Nesses átomos os números de nêutrons são, respectivamente, iguais a:
A) 0, 1 e 2.
B) 1, 1 e 1.
C) 1, 1 e 2.
D) 1, 2 e 3.
E) 2, 3 e 4
Resolução:
Alternativa A
A massa atômica (A) é dada pela soma do número de prótons (Z) com o número de nêutrons (N). A = Z + N, logo, N = A – Z. Sendo assim:
- Prótio: N = 1 – 1; A = 0;
- Deutério: N = 2 – 1; A = 1;
- Trítio: N = 3 – 1; A = 2.
Questão 2
(Uerj)
O desastre de Chernobyl ainda custa caro para a Ucrânia. A radiação na região pode demorar mais de 24.000 anos para chegar a níveis seguros. Após 30 anos do acidente em Chernobyl, o principal contaminante radioativo presente na região é o césio-137, que se decompõe formando o bário-137.
Adaptado de Revista Superinteressante, 12/08/2016.
Esses átomos, ao serem comparados entre si, são denominados:
A) isótopos
B) isótonos
C) isóbaros
D) isoeletrônicos
Resolução:
Alternativa C
Ambos têm massa 137, logo, são isóbaros. Isso devido à soma do número de prótons e nêutrons de cada núcleo ser o mesmo valor.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Fundamentos: Os elementos e os átomos. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. [s.l.] Bookman, 2018. p. 693–697.
BAETA, A. Stable Isotope Ecology. In: Encyclopedia of Ecology. 2a ed. Coimbra: Elsevier, 2019. v. 3p. 606–615.
BROOK, E. J. ICE CORE METHODS | Stable Isotopes. In: Encyclopedia of Quaternary Science. [s.l.] Elsevier, 2013. p. 347–352.
KÓNYA, J.; NAGY, N. M. Isotopes. In: Nuclear and Radiochemistry. [s.l.] Elsevier, 2018. p. 25–47.
L. BROWN, T. et al. Números atômicos, números de massa e isótopos. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 51–52.
WERNER, R. A.; CORMIER, M. A. Stable Isotopes in Tree Rings Inferring Physiological, Climatic and Environmental Responses. In: Intrinsic Water-Use Efficiency Derived from Stable Carbon Isotopes of Tree-Rings. [s.l: s.n.]. p. 481–498.