Ligações químicas
Ligações químicas são feitas por átomos para terem maior estabilidade e assim formarem diversos compostos. Essas ligações podem ser iônicas, covalentes ou metálicas.
Por Stéfano Araújo Novais

PUBLICIDADE
As ligações químicas são feitas pelos átomos para que estes possam se tornar estáveis. Para que os átomos possam se ligar, é necessário que eles envolvam seus elétrons da camada de valência, seja doando-os para outro átomo, como no caso da ligação iônica, seja compartilhando-os com outro átomo, como no caso da ligação covalente. Há também uma terceira modalidade de ligação química, específica para os átomos metálicos, cujo nome é ligação metálica.
De acordo com a ligação química realizada é que podemos classificar as substâncias. Os compostos iônicos são formados pelas ligações iônicas, as moléculas são formadas pelas ligações covalentes e os metais são formados pelas ligações metálicas. Elas também diferem quanto à força: a ligação metálica é mais forte, sendo sucedida pela ligação iônica e então a covalente.
Leia também: Geometria molecular – disposição espacial dos átomos na molécula
Resumo sobre as ligações químicas
-
Átomos se ligam para adquirir maior estabilidade química.
-
A regra do octeto é uma teoria para determinar quando um átomo se torna estável.
-
Segundo a regra do octeto, um átomo se estabiliza ao ter oito elétrons na camada de valência ou adquirir a mesma configuração eletrônica do gás nobre mais próximo na Tabela Periódica.
-
A ligação iônica ocorre quando um átomo doa elétrons para outro átomo.
-
A ligação covalente ocorre quando átomos compartilham pares de elétrons.
-
Elétrons livres mantêm íons metálicos unidos na ligação metálica, de acordo com a teoria do mar de elétrons.
Videoaula sobre ligações químicas
Regra do octeto
Como mencionado, as ligações químicas são feitas pelos átomos para que estes possam se tornar estáveis, mas o que de fato significa um átomo ser estável? Existem diversas regras desenvolvidas para que se possa explicar a estabilidade das espécies atômicas, e uma delas é a regra do octeto.
A regra do octeto tem esse nome, pois se baseia na configuração eletrônica dos gases nobres, já que, à exceção do elemento hélio, todos eles possuem oito elétrons na camada de valência. Vejamos o caso dos quatro primeiros gases nobres: hélio (He), neônio (Ne), argônio (Ar) e criptônio (Kr).
-
2He - 1s2
-
10Ne - 1s2 2s2 2p6
-
18Ar - 1s2 2s2 2p6 3s2 3p6
-
36Kr - 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Em suma, pode-se dizer, então, que, pela regra do octeto, um átomo se estabiliza ao adquirir oito elétrons na camada de valência ou quando adquire a configuração eletrônica do gás nobre mais próximo a ele na Tabela Periódica.
Ligação iônica
A ligação iônica ocorre quando um átomo doa elétrons para outro átomo. O átomo que doa é sempre uma espécie de baixa energia de ionização, ou seja, perde elétrons com mais facilidade; já o átomo que recebe é sempre uma espécie de alta afinidade eletrônica, ou seja, tem mais facilidade em receber elétrons. Os elétrons doados e recebidos são sempre os da camada de valência, que, por ser a camada mais externa, é a que sofre menos atração pelo núcleo atômico. Por causa dessa harmonia é que a ligação iônica é considerada uma ligação forte.
Como, em geral, os metais são espécies de baixa energia de ionização e os ametais são espécies de alta afinidade eletrônica, muitos identificam que a ligação iônica ocorre sempre entre um metal e um ametal.
Exemplo 1:
Um exemplo clássico de ligação iônica é a que ocorre entre o sódio (Na) e o cloro (Cl).
O átomo de sódio possui número atômico igual a 11, logo, possui 11 prótons. Como todo átomo é uma espécie eletricamente neutra, o átomo de sódio também possui 11 elétrons, assim, sua distribuição eletrônica é: 1s2 2s2 2p6 3s1.
A camada de valência do sódio é a que contém o subnível 3s1, e, caso ele perca esse elétron, terá uma nova camada de valência — 2s2 2p6 —, que já possui oito elétrons e, por isso, faria-o estável.
Já o cloro é um átomo que possui número atômico igual a 17, logo, possui 17 prótons. Mais uma vez, por ser uma espécie eletricamente neutra, o átomo de cloro também possui 17 elétrons. Sua distribuição eletrônica é, então: 1s2 2s2 2p6 3s2 3p5.
Como se vê, a camada de valência do cloro é a que contém os subníveis 3s2 e 3p5 (com sete elétrons), e, nesse caso, o cloro precisa de apenas um elétron a mais nessa camada para adquirir oito elétrons nela e então se estabilizar. Por isso, sódio e cloro se ligam, pois o sódio doa o elétron para o cloro, conforme o esquema abaixo mostra:
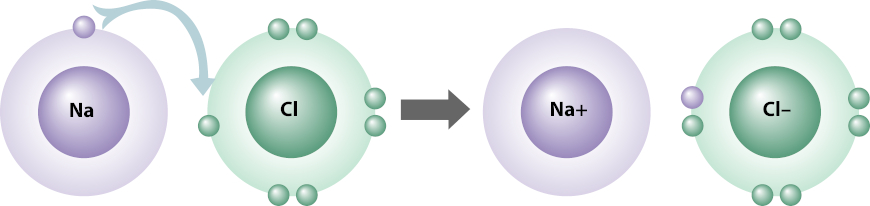
Ao demonstrarmos uma ligação iônica, não há a necessidade de representar todos os elétrons de cada átomo, mas apenas os elétrons de valência. A utilização de setas é comum e recomendada para que se mostre a espécie que doa e a espécie que recebe o(s) elétron(s).
Como o sódio perde um único elétron, ele se torna um cátion (íon positivo), Na+. Já o cloro, como recebe um elétron, torna-se um ânion (íon negativo), Cl–.
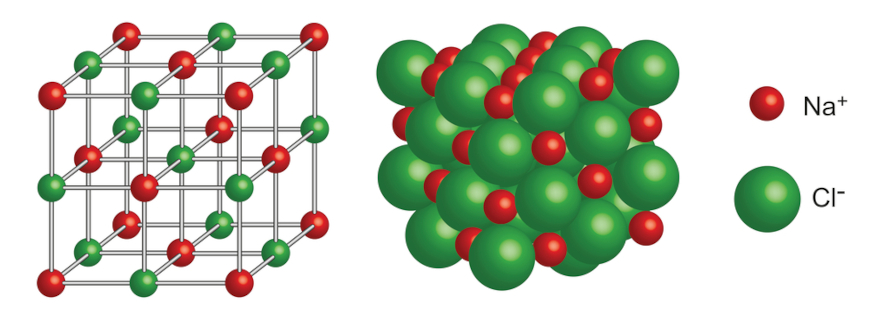
O composto gerado, NaCl, é chamado de cloreto de sódio e é o sal de cozinha, um tempero amplamente utilizado. Na sua forma sólida, como comumente conhecemos, o cloreto de sódio tem uma estrutura espacial muito bem definida, em que os íons de sódio e cloro se alternam, estabilizando a estrutura, uma vez que possuem cargas opostas.
Outra forma de identificarmos se um composto é iônico é pela diferença dos valores de eletronegatividade de cada átomo participante do composto. Caso essa diferença seja maior que 1,70, nós dizemos que esse composto é iônico.
Por exemplo, a eletronegatividade do sódio é de 0,93, enquanto a eletronegatividade do cloro é de 3,16. Se fizermos a diferença, temos que:
3,16 – 0,93 = 2,23
Como 2,23 é maior que 1,70, podemos afirmar que o cloreto de sódio é um composto iônico.
Exemplo 2:
Veja outro exemplo de ligação iônica, entre o metal alcalinoterroso cálcio (Z = 20) e o halogênio flúor (Z = 9).
- Distribuição eletrônica do cálcio: 1s2 2s2 2p6 3s2 3p6 4s2 → Precisa perder dois elétrons para se estabilizar.
- Distribuição eletrônica do flúor: 1s2 2s2 2p5 → Precisa ganhar um elétron para se estabilizar.
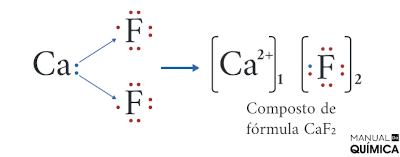
Perceba nesse exemplo que, como o cálcio precisa perder dois elétrons, um átomo de flúor não é suficiente (pois o flúor só necessita de um elétron para se estabilizar), dessa forma, são necessários dois átomos de flúor para que o composto se torne estável.
O cálcio possui uma eletronegatividade de 1,00, enquanto a eletronegatividade do flúor é de 3,98. Assim, a diferença entre as eletronegatividades é de 2,98, que é um valor maior que 1,70, confirmando que se trata de um composto iônico.
Veja também: Como realizar a distribuição eletrônica de íons?
Ligação covalente
A ligação covalente ocorre quando os átomos compartilham entre si os seus elétrons. Diferentemente da ligação iônica, na ligação covalente os átomos envolvidos não possuem características antagônicas, mas sim semelhantes.
Percebe-se que a ligação covalente ocorre entre átomos de ametais, que são espécies que possuem alta energia de ionização (não perdem elétrons com facilidade) e alta afinidade eletrônica (mais facilidade em receber elétrons). Como os átomos envolvidos possuem características semelhantes e necessitam simultaneamente ganhar elétrons para se estabilizar, o que ocorre é um compartilhamento dos elétrons das camadas de valência para estabilizar a espécie gerada, a qual é chamada de molécula.
Exemplo 1:
Vejamos o caso da molécula de água, cuja fórmula é H2O.
- Distribuição eletrônica do hidrogênio (H, Z = 1): 1s1 → Precisa ganhar um elétron para se estabilizar.
- Distribuição eletrônica do oxigênio (O, Z = 8): 1s2 2s2 2p4 → Precisa ganhar dois elétrons para se estabilizar.
Nesse caso, como podemos ver logo abaixo, o oxigênio compartilha dois dos seus seis elétrons de valência com o único elétron de valência de cada átomo de hidrogênio. Assim, os pares de elétrons gerados são compartilhados entre o oxigênio e os respectivos átomos de hidrogênio. Consideramos, então, que o oxigênio fica com oito elétrons (seus seis originais, mais os dois adquiridos através dos hidrogênios no compartilhamento) e cada hidrogênio fica com dois elétrons (seu elétron original, mais o elétron adquirido no compartilhamento com o oxigênio).
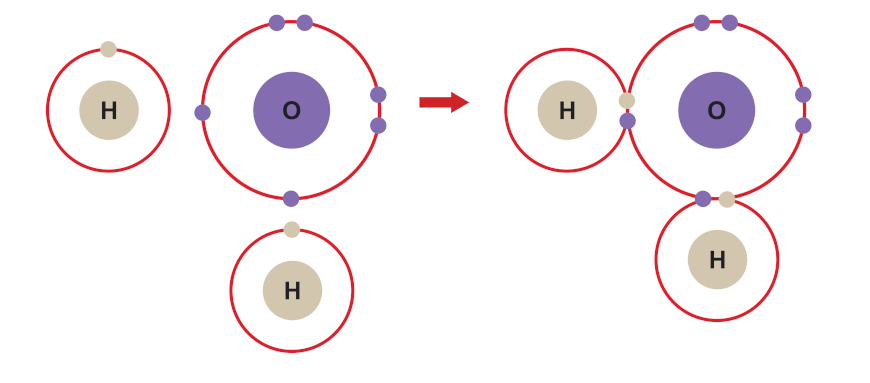
O composto covalente (ou molécula) formado é geralmente representado por uma fórmula estrutural característica, como a que se segue:

Nessa notação, cada par de elétrons compartilhado entre os átomos é substituído por uma barra. Alguns autores também decidem representar os pares de elétrons não ligantes, ou seja, os que não fazem nenhuma ligação covalente, com pequenas esferas sobre o átomo a que eles pertencem.
Também é possível que os átomos compartilhem mais de um par de elétrons, podendo chegar, na verdade, a três pares de elétrons compartilhados entre os mesmos átomos.
Exemplo 2:
Veja o caso do CO2, comumente chamado de gás carbônico.
- Distribuição eletrônica do carbono (C, Z = 6): 1s2 2s2 2p2 → Precisa ganhar quatro elétrons para se estabilizar.
- Distribuição eletrônica do oxigênio (O, Z = 8): 1s2 2s2 2p4 → Precisa ganhar dois elétrons para se estabilizar.
Cada átomo de oxigênio, nessa estrutura, compartilha seus dois elétrons de valência com dois dos quatro elétrons de valência do carbono, estabelecendo o que nós chamados de uma ligação covalente dupla. Assim, consideramos que cada átomo de oxigênio pode considerar mais dois elétrons na sua estrutura e que o carbono pode considerar mais quatro elétrons na sua estrutura.
![]()
Exemplo 3:
O gás nitrogênio, N2, é um exemplo em que três pares de elétrons são compartilhados entre os mesmos átomos.
- Distribuição eletrônica do nitrogênio (N, Z = 7): 1s2 2s2 2p3 → Precisa ganhar três elétrons para se estabilizar.
Cada átomo de nitrogênio utiliza três dos seus cinco elétrons de valência para estabelecer uma ligação covalente tripla, como mostra a estrutura a seguir.
![]()
Outra forma de identificar se uma substância é covalente é pela diferença de eletronegatividade dos átomos. No caso dos compostos covalentes, a diferença entre os valores de eletronegatividade deve ser menor que 1,70. No caso da água, o hidrogênio possui eletronegatividade igual a 2,20 e o oxigênio possui eletronegatividade igual a 3,44. A diferença, então, será:
3,44 – 2,20 = 1,24
Como 1,24 é menor que 1,70, podemos confirmar que a água se trata de um composto covalente.
Exemplo 4:
Quando um átomo já completou o octeto, mas ainda precisa fazer ligações covalentes, podemos estabelecer o compartilhamento usando elétrons de valência de apenas um átomo e não de dois, como tradicionalmente ocorre. É o caso do SO2.
Tanto o enxofre quanto o oxigênio possuem seis elétrons na camada de valência, ou seja, ambos precisam ganhar dois elétrons para se estabilizar. Nesse caso, o enxofre compartilha dois de seus elétrons de valência com outros dois elétrons de valência de um dos átomos de oxigênio. Ao fazer isto, tanto o oxigênio quanto o enxofre adquirem oito elétrons na camada de valência.
Para que se possa ligar o outro átomo de oxigênio, a nova ligação formada possui apenas a participação dos elétrons de valência do enxofre, sem mobilizar os elétrons de valência do outro átomo de oxigênio. Assim, todos os átomos ficam com oito elétrons na camada de valência e obedecem aos critérios da regra do octeto.

Alguns autores costumam chamar essa ligação covalente, em que se mobiliza apenas o par de elétrons de um átomo, de ligação covalente dativa ou ligação covalente coordenada, representando-a com uma seta.
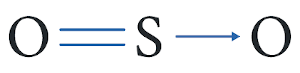
Leia também: Como ocorre a alotropia do enxofre?
Exceções à regra do octeto
Alguns compostos covalentes acabam sendo exceções à regra do octeto, o que quer dizer que alguns dos átomos desses compostos não se estabilizam com oito elétrons na camada de valência, mas com menos ou mais que oito elétrons.
Os átomos de boro (B) e berílio (Be) são casos de elementos que se estabilizam com menos que oito elétrons. Frequentemente percebemos o berílio se estabilizando com quatro elétrons na camada de valência, como no caso do BeH2, e o boro se estabilizando com seis elétrons na camada de valência, como é o caso do BH3.
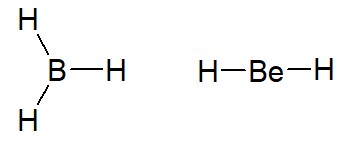
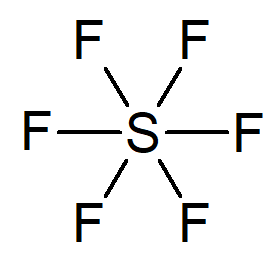
Já o enxofre, no composto SF6, faz o que chamamos de expansão do octeto, ou seja, estabiliza-se com mais de oito elétrons na camada de valência (no caso, 12 elétrons).
A molécula do NO2 traz outra exceção interessante à regra do octeto. Nessa molécula, podemos considerar a presença de um elétron desemparelhado, ou seja, um elétron não ligante isolado, sem ter outro elétron para fazer um par. Isso pode ocorrer quando o somatório dos elétrons de valência dos átomos da molécula for ímpar. No NO2, o nitrogênio tem cinco elétrons de valência e cada oxigênio tem seis, logo, o somatório é igual a 17 elétrons.

Por conta dessas falhas da regra do octeto, alguns livros trazem teorias mais modernas para explicar de forma única a formação dos compostos, entretanto, tal discussão foge das necessidades de conhecimento do ensino básico.
Ligação metálica
Os metais, como mencionado, são espécies químicas que possuem uma baixa energia de ionização, o que quer dizer que perdem elétrons de valência com facilidade. Com base nessa propriedade, cientistas desenvolveram a teoria do mar de elétrons para justificar a ligação entre átomos de um determinado metal.
Segundo essa teoria, os átomos do metal estariam em posições bem definidas com seus elétrons de valência totalmente livres pela estrutura. Assim, os metais estariam com uma carga positiva e sendo estabilizados por esse amontoado de elétrons livres, de carga negativa, dando a sensação de que os cátions metálicos estariam submersos em um mar de elétrons.
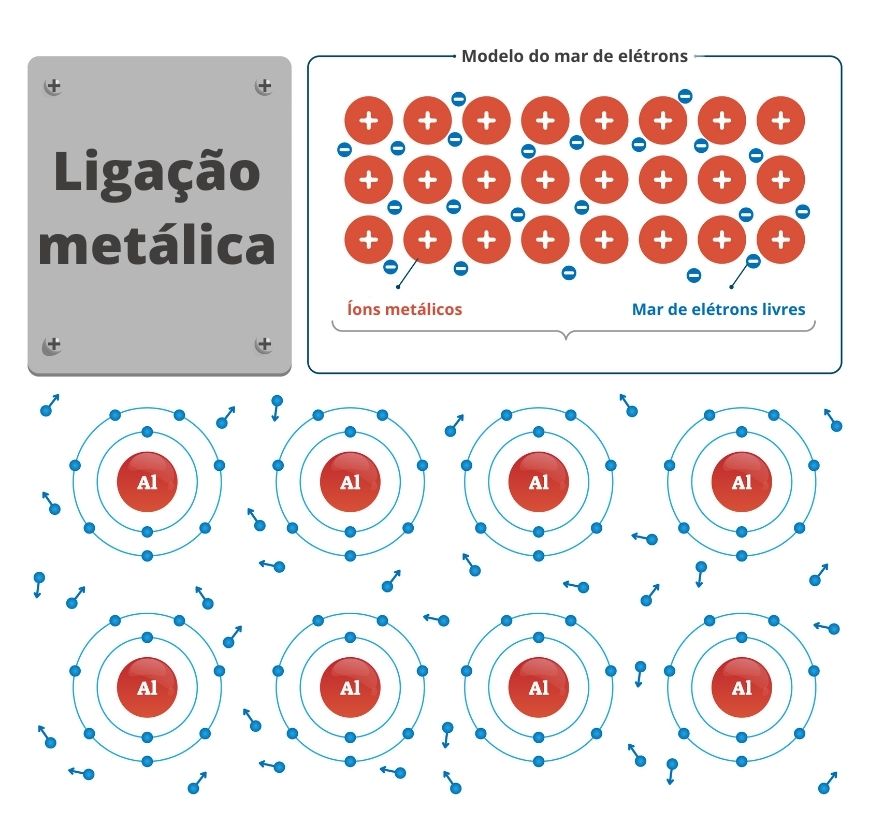
Assim como a presença dos elétrons entre dois átomos os mantém unidos numa ligação covalente, a presença dos elétrons livres nesse mar de elétrons é que mantém os átomos metálicos unidos, no que conhecemos como ligação metálica.
Entretanto, vale salientar que, nesse modelo de ligação metálica, os átomos dos metais não obedecem à regra do octeto.
A teoria do mar de elétrons serve para explicar o porquê dos metais conduzirem corrente elétrica no estado sólido. Sabe-se que corrente elétrica é o mesmo que cargas em movimento, em um fluxo ordenado. Como o elétron é uma carga elétrica, ao se aplicar uma diferença de potencial, ele pode manter um fluxo pela estrutura do metal, uma vez que está livre para se movimentar. Esse movimento dos elétrons é, então, a corrente elétrica que o metal conduz.
Apesar de explicar alguns comportamentos dos compostos metálicos, a teoria do mar de elétrons já foi refutada por teorias mais modernas, porém também mais complexas, as quais envolvem conhecimentos prévios de mecânica quântica e não são debatidas no ensino básico.
Veja também: Como ocorre as reações de simples troca com metais?
Videoaula sobre ligações químicas no Enem
Exercícios resolvidos sobre ligações químicas
Questão 1 - (UERJ) Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela abaixo:
|
Material |
Composição química |
|
I |
C |
|
II |
S |
|
II |
As |
|
IV |
Fe |
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte número:
-
I
-
II
-
III
-
IV
Resolução
Alternativa D. Ao observarmos o enunciado da questão, vemos que ele diz: “Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade”.
Sendo assim, devemos utilizar um material cuja composição química seja de um átomo capaz de realizar ligações metálicas.
As ligações metálicas só ocorrem entre metais, e, sendo assim, o gabarito deve ser o da letra D, pois o material IV é o que contém ferro (Fe).
Questão 2 - (Uespi) O fosgênio (COCl2), um gás incolor, tóxico, de cheiro penetrante, utilizado na 1ª Guerra Mundial como gás asfixiante, é produzido a partir da reação:
CO (g) + Cl2 (g) → COCl2 (g)
Sobre a molécula do fosgênio, podemos afirmar que ela apresenta:
A) duas ligações duplas e duas ligações simples.
B) uma ligação dupla e duas ligações simples.
C) duas ligações duplas e uma ligação simples.
D) uma ligação tripla e uma ligação dupla.
E) uma ligação tripla e uma ligação simples.
Resolução
Alternativa B. O fosgênio, por ser uma molécula, é um composto covalente. Assim, todas as ligações nesse composto são covalentes. Vamos à configuração eletrônica de cada átomo presente no fosgênio.
Cl (Z = 17): 1s2 2s2 2p6 3s2 3p5 → Precisa ganhar um elétron para se estabilizar.
O (Z = 8): 1s2 2s2 2p4 → Precisa ganhar dois elétrons para se estabilizar.
C (Z = 6) 1s2 2s2 2p2 → Precisa ganhar quatro elétrons para se estabilizar
Nessas situações de moléculas que possuem mais de dois elementos, convenciona-se que o átomo que precisa de mais elétrons para se estabilizar (ou seja, que necessita fazer mais ligações covalentes) fique no centro, enquanto os outros átomos o circundam.
Como a cada ligação covalente realizada nós consideramos o acréscimo de um elétron na estrutura, o carbono precisa fazer quatro ligações covalentes, o oxigênio precisa de duas ligações covalentes e cada átomo de cloro precisa fazer uma ligação covalente.
Todos os átomos precisam estar ligados entre si, numa única estrutura. Sendo assim, os átomos de cloro não podem se ligar entre si, do contrário, não poderiam mais se ligar com nenhum outro átomo. Da mesma forma, o oxigênio usa suas duas ligações para se ligar aos dois átomos de cloro, pois, caso fizesse isso, o carbono não se ligaria a nenhum átomo.
A única possibilidade para que todos os elementos completem o octeto é a que se vê abaixo:
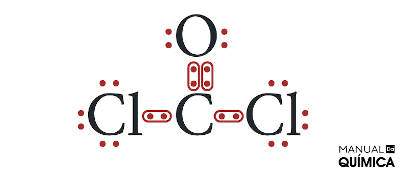
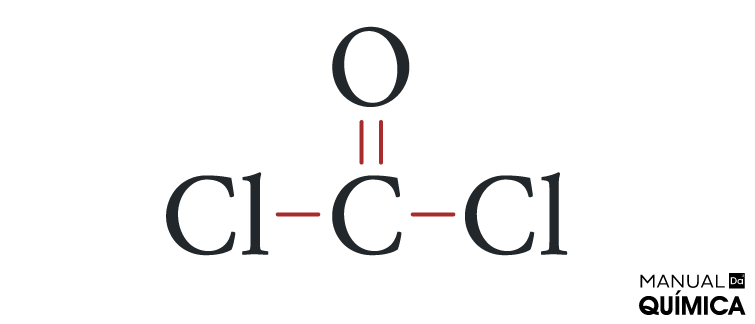
Assim, podemos perceber que o fosgênio realiza uma ligação dupla e duas ligações simples, o que está descrito na letra B.