Massa Atômica
A massa atômica de um átomo é a massa determinada em “u” (unidades de massa atômica), isto é, a massa comparada com um doze avos da massa de um átomo de carbono 12.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Muitas vezes em cálculos estequiométricos é preciso saber a massa dos átomos ou de um elemento químico. No entanto, essas espécies são entidades muito pequenas, que não podem simplesmente ser “pesadas” em uma balança.
Mas nós podemos relacionar as massas de diferentes átomos. Na realidade, quando usamos uma balança, estamos fazendo uma relação também. Estamos relacionando a massa do objeto em questão com a massa de um quilograma (kg), que é a unidade padrão escolhida desde 1960 pelo Sistema Internacional de Unidades (SI).
O quilograma-padrão equivale a um cilindro de 3,917 cm de altura e de diâmetro, feito de 10% de irídio e de 90% de platina. Ele fica guardado no interior de três cúpulas de vidro na sede do Bureau Internacional de Pesos e Medidas, na cidade de Sèvre, França. A imagem abaixo é um pouco mais antiga, por isso tem apenas duas cúpulas:

Quilograma-padrão no Bureau Internacional de Pesos e Medidas, Sèvre, França
Ele serve como padrão de comparação. Por exemplo, no caso da imagem abaixo, vemos que a massa da melancia é igual a 6 kg, isso significa que sua massa é seis vezes maior que o padrão escolhido: 1 kg.

Comparação de massas na balança
O mesmo princípio é seguido para se determinar a massa atômica de um átomo, sendo que o padrão escolhido foi o isótopo mais comum do átomo de carbono, que é o que possui número de massa (A) igual a 12 (12 prótons + 12 nêutrons): 12C. A esse átomo foi atribuída a massa de exatamente 12 unidades de massa atômica, que é uma unidade simbolizada por “u”.
Portanto, podemos enunciar o seguinte:
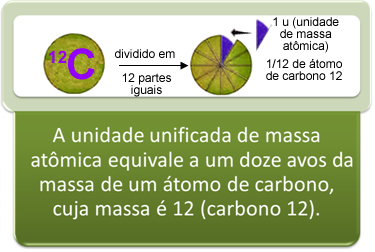
A unidade de massa atômica é 1/12 da massa do carbono-12
Assim, para se descobrir a massa atômica de um átomo, basta relacionar com a unidade de massa atômica, 1 u. Por exemplo, a massa atômica do enxofre é 32 u, o que significa que sua massa é 32 vezes maior que 1/12 da massa do 12C.
Importante saber →1 u é igual a 1,66054 . 10-24 g.
Atualmente, usa-se um aparelho denominado espectrômetro de massas que determina com precisão a massa atômica de diversos elementos, como mostrado na tabela a seguir:
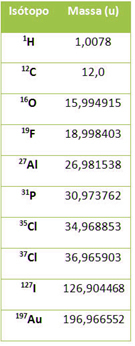
Massas atômicas de alguns isótopos determinadas por um espectrômetro de massas
A fim de facilitar os cálculos, esses números costumam ser arredondados, ficando iguais ao número de massa (A) do átomo. No entanto, lembre-se de que massa atômica (MA) e número de massa (A) são totalmente diferentes, pois a massa atômica é a relação com a massa de 1/12 do 12C, enquanto o número de massa é a soma dos prótons e dos nêutrons no núcleo atômico.
-
Massa atômica de um elemento:
A massa atômica de um elemento químico aparece na Tabela Periódica geralmente na parte inferior, abaixo do símbolo do elemento. Abaixo vemos que a massa atômica do Neônio é 20,1797.

Massa atômica do elemento neônio
Como se chegou a esse valor? Bom, no caso de elementos químicos, não podemos usar o mesmo valor do número de massa, porque os elementos que aparecem na Tabela Periódica não são compostos apenas por um tipo de átomo, mas sim pela média ponderada de seus isótopos. Cada um desses isótopos possui números de massas diferentes, como se pode ver no caso do neônio, que é composto por três isótopos:
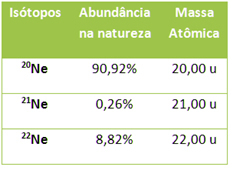
Massas atômicas e porcentagem de isótopos do neônio
A massa atômica do elemento é calculada levando-se em consideração a massa de cada isótopo e a abundância com que ele aparece na natureza. No caso do neônio, temos:
Massa atômica do elemento neônio = (20,00 . 90,92) + (21,00 . 0,26) + (22,00 . 8,82)
100
Massa atômica do elemento neônio = 20,179
Esse é o valor que aparece na Tabela Periódica para esse elemento químico.
Aproveite para conferir as nossas videoaulas relacionadas ao assunto: