Volume molar
Volume molar é o espaço ocupado, em litros, por 1 mol de qualquer matéria no estado gasoso e em condições normais de temperatura e pressão (CNTP).
Por Diogo Lopes Dias
PUBLICIDADE
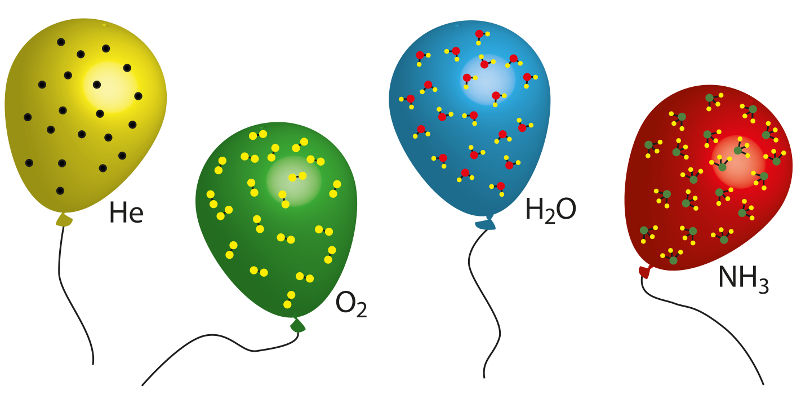
Amadeo Avogadro contribuiu com o conhecimento do volume molar, determinando em seus estudos a seguinte lei: quando temos volumes iguais, de dois ou mais gases, sempre haverá a mesma quantidade de matéria (denominada mol), seja de moléculas, seja de átomos. Temos, por exemplo, um mol de moléculas de CO2 e um mol de átomos no caso de um gás nobre.
A lei de Avogadro é aplicada apenas se o gás, ou os gases, estiver em condições normais de temperatura e pressão (CNTP), ou seja:
-
Pressão = 1 atm
-
Temperatura = 0oC ou 273K
-
Constante geral dos gases (R) = 0,082
-
Número de mol = 1 mol
Baseados nesses dados e conhecendo a equação de Clapeyron, demonstrada abaixo:
P.V = n.R.T
1.V = 1.0,082.273
V = 22,386 L
Temos condição de determinar o volume molar. O espaço ocupado por um mol de um gás é igual a 22,386 L ou, simplesmente, 22,4 L. Assim, as seguintes relações podem ser utilizadas:
1 mol de moléculas----------6,02.1023 moléculas--------ocupam um volume de 22,4 L
1 mol de átomos----------6,02.1023 átomos--------ocupam um volume de 22,4 L
A seguir, você poderá ter uma noção de como o volume molar é cobrado nos exercícios:
Exemplo 1- (Faap-SP) Nas condições normais de temperatura e pressão, qual o volume ocupado por 35,5 g de cloro gasoso (Cl2)? Dado: Cl = 35,5 u.
a) 9,85 L
b) 11,2 L resposta correta
c) 13,4 L
d) 18,2 L
e) 22,4 L
O exercício indica a massa do gás cloro utilizada (35,5 g) e questiona o volume que ela ocupará. Assim, basta seguir as seguintes etapas:
-
Calcular a massa molar (M) do gás cloro
Nesse caso, basta multiplicar a massa atômica pelo número de átomos de cloro na fórmula molecular:
M = 2.35,5
M = 71 g/mol
-
Calcular o volume ocupado pelo gás
Em seguida, devemos montar uma regra de três utilizando massa e volume molar:
1mol de Cl2--------71g---------22,4 L
35,5g---------x
71.x = 35,5.22,4
71x = 795,2
x = 795,2
71
x = 11,2 L
Exemplo 2 - (UFF) Assinale a alternativa correspondente ao volume ocupado por 0,25 mol de gás carbônico (CO2) nas condições normais de temperatura e pressão (CNTP):
a) 0,25 L
b) 0,50 L
c) 5,60 L resposta correta
d) 11,2 L
e) 22,4 L
O exercício indica a quantidade de gás carbônico utilizada (0,25 mol) e questiona o volume que ela ocupará. Assim, basta montar uma regra de três utilizando mol e volume molar:
1mol de CO2--------22,4 L
0,25 mol---------x
1x = 0,25.22,4
x = 5,6 L