Ácidos
Os ácidos são toda substância que, em solução aquosa, sofre ionização, liberando como único cátion o hidrônio (ou hidrogênio).
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Visto que existe uma infinidade de substâncias em nosso planeta, os químicos decidiram separá-las em grupos cujos membros apresentam propriedades químicas semelhantes. Esses grupos são chamados de funções químicas.
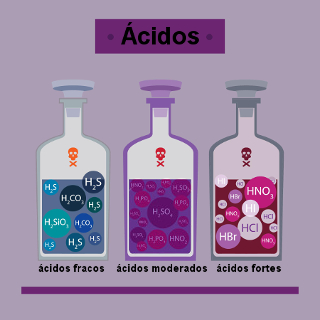
Um desses grupos é o da função inorgânica dos ácidos. Os ácidos têm várias aplicações e estão presentes em vários produtos de nosso cotidiano. Por exemplo, frutas como limão e laranja possuem o ácido cítrico (C6H8O7); na bateria de automóveis há uma solução de ácido sulfúrico (H2SO4); o ácido muriático é usado para limpezas de azulejos; pedras têm como principal componente o ácido clorídrico impuro (HCl) e o vinagre possui o ácido acético (C2H4O2).

Exemplos de ácidos no cotidiano (em produtos de limpeza, baterias, no vinagre e em frutas)
Os ácidos presentes nas frutas mencionadas e no vinagre possuem sabor azedo que é característico desses compostos. Porém, esse não deve ser o fator que deve ser usado para identificar se algum composto faz parte dessa função, pois muitos ácidos são extremamente tóxicos e corrosivos, como o ácido sulfúrico da bateria de carros.

Muitos ácidos são perigosos, pois são tóxicos e corrosivos
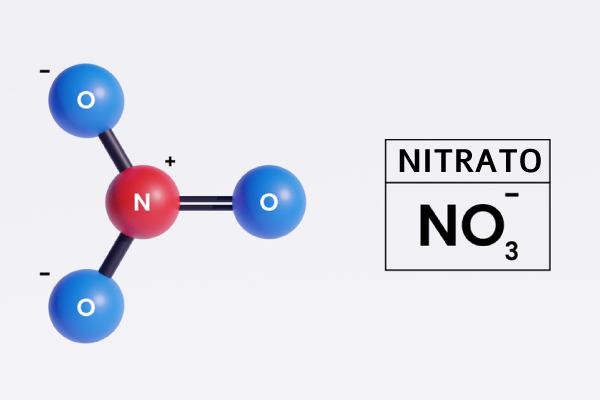
Portanto, os cientistas usam outros critérios. Um deles é seguir a teoria de Arrhenius que diz o seguinte:

Definição de ácidos segundo a teoria de Arrhenius
Por exemplo, o HCl (cloreto de hidrogênio) é um composto covalente, formado pelo compartilhamento de um par de elétrons entre o hidrogênio e o cloro. O cloro é mais eletronegativo que o hidrogênio e, por isso, atrai os elétrons mais fortemente para si, criando um dipolo elétrico na molécula.
Assim, quando esse composto é colocado em água, o hidrogênio da molécula de HCl, que está positivamente carregado, é atraído pelo oxigênio da molécula de água, que é mais eletronegativo que o cloro. Desse modo, estabelece-se uma ligação covalente formando o cátion hidrônio (H3O+) em solução aquosa:
HCl(g) + H2O(l) → H3O+(aq) + Cl-(aq)
Esse mesmo processo de ionização com liberação do cátion hidrônio (H3O+) ocorre com todos os ácidos colocados em contato com a água. Observe mais exemplos abaixo:
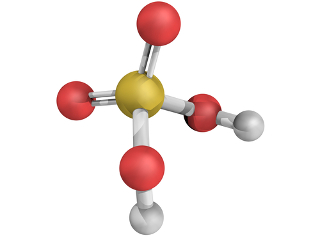
H2SO4(l) + 2 H2O(l) → 2 H3O+(aq) + SO42-(aq)
H3PO4(s) + 3 H2O(l) → 3 H3O+(aq) + PO43-(aq)
H3CCOOH (l) + H2O(l) → H3O+(aq) + H3CCOO-(aq)
Por comodidade, costuma-se usar somente o cátion hidrogênio:
H2SO4(aq) → 2 H+(aq) + SO42-(aq)
H3PO4(aq) → 3 H+(aq) + PO43-(aq)
H3CCOOH(aq) → H+(aq) + H3CCOO-(aq)
Na realidade, a espécie mínima que se forma na água não é nem o cátion hidrônio nem o hidrogênio, mas sim o seguinte cátion hidrônio hidratado (H3O . 3 H2O)+ ou H9O4+. Mas, para simplificar, usam-se as outras representações.
Esse cátion que é liberado é o responsável por todas as características que distinguem os ácidos dos outros grupos. Veja algumas dessas características comuns a todos os ácidos:
-
Formam soluções aquosas condutoras de eletricidade: Conforme já dito e como mostram as equações acima, em solução aquosa, os ácidos liberam íons para o meio que conduzem corrente elétrica;
-
Mudam a cor de certas substâncias: Os indicadores de ácidos mudam de cor na presença desses compostos. Por exemplo, a solução alcoólica de fenolftaleína é um indicador que fica incolor em meio ácido e fica rosa em alguma base; já o papel de tornassol fica vermelho em meio ácido e azul em meio básico, como mostra a figura abaixo:

Papel de tornassol fica vermelho em contato com limão ácido
-
Reagem com muitos metais: Nessa reação, os metais são corroídos e se produz gás hidrogênio.
Exemplo: Mg(s) + 2 HCl(aq) → MgCl2(aq) + H2(g)
-
Reagem com carbonatos e bicarbonatos: Nessa reação é liberado gás carbônico.
Exemplo: CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Por Jennifer Fogaça
Graduada em Química
Videoaulas relacionadas: