Classificação dos ácidos
A classificação dos ácidos é importante para sabermos qual é a sua força, quantos hidrogênios se ionizam em meio aquoso e se são voláteis ou não.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Os ácidos são compostos que, segundo a Teoria de Arrhenius, ionizam-se ao serem colocados na água, liberando como único cátion o H+(aq) (ou H3O+(aq)). Esse conceito faz parte dos vários critérios usados para a classificação dos ácidos. Veja os principais:
-
Quanto à presença de oxigênio:
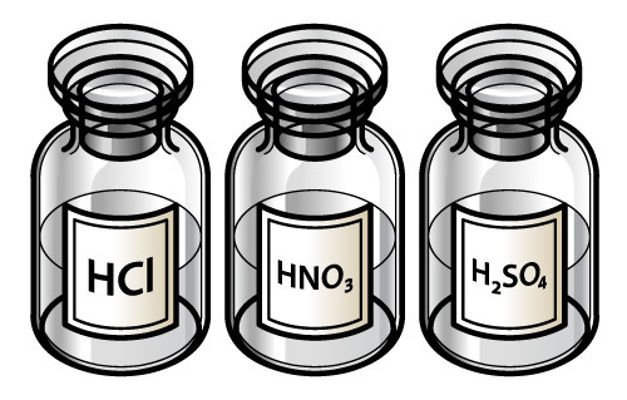
-Hidrácido: não possui oxigênio. Exemplos: HCl, HBr, H2S;
-Oxiácido: possui oxigênio: Exemplos: H2SO4, HClO4, HNO3.
-
Quanto ao número de hidrogênios ionizáveis (hidrogênios liberados em meio aquoso na forma de seu cátion H+(aq)):
-Monoácido: libera um H+(aq);
-Diácido: libera dois H+(aq);
-Triácido: libera três H+(aq);
-Tetrácido: libera quatro H+(aq).
No caso dos hidrácidos, todos os hidrogênios que ele possuir serão ionizáveis. Portanto, temos:
HCl: monoácido = 1 HCl + 1 H2O → 1 H3O++ 1 Cl-
H2S: diácido = 1 H2S + 2 H2O → 2 H3O+ + 1 S2-
Porém, no caso dos oxiácidos, somente os hidrogênios ligados diretamente com os átomos de oxigênio é que serão ionizáveis. Veja os exemplos:
H3BO3: triácido = 1 H3BO3 + 3 H2O → 3 H3O+ + 1 BO33-
H − O − B − O − H → Todos os hidrogênios são ionizáveis,
| porque os três estão ligados aos oxigênios.
O
|
H
H2SO4: diácido = 1 H2SO4 + 2 H2O → 2 H3O+ + 1 SO42-
O
↑
H − O − S − O − H → Todos os hidrogênios são ionizáveis,
↓ porque os dois estão ligados aos oxigênios.
O
H3PO3: diácido = 1 H3PO3 + 2 H2O → 2 H3O+ + 1 HPO33-
O
↑
H − O − P − O − H → Apesar de possuir três hidrogênios na molécula,
| somente dois são ionizáveis.
H
H3PO2: monoácido = 1 H3PO2 + 1 H2O → 1 H3O+ + 1 H2 PO23-
O
↑
H − O − P − H → Apesar de possuir três hidrogênios na molécula,
| somente um é ionizável.
H
Observe que o HCl é um monoácido, enquanto o H3BO3 é um triácido. No entanto, em solução aquosa, o HCl forma um ácido forte, o ácido clorídrico, que é corrosivo, sendo, por isso, usado em produtos de limpeza e em decapagem de metais; enquanto o H3BO3 forma um ácido fraco, o ácido bórico, que é usado até mesmo em colírios graças à sua ação antisséptica.
Isso nos leva a concluir que não é a quantidade de hidrogênios ionizáveis que torna um ácido forte ou fraco. Na verdade, a força de um ácido é definida de acordo com o próximo critério de classificação dos ácidos:
-
Grau de ionização (α):
O grau de ionização de um ácido é calculado da seguinte forma:
α = quantidade de moléculas que se ionizaram_________ . 100%
quantidade de moléculas que inicialmente foram dissolvidas
Isso quer dizer que quanto maior for o grau de ionização, maior será a concentração de íons presentes na solução, o que faz com que o ácido tenha maior condutibilidade elétrica e seja mais forte.
Assim, temos:
- α > 50%: ácido forte.
Exemplos: Como mostra a imagem inicial, o HNO3 e o HCl são fortes porque o grau de ionização de cada um é, respectivamente, igual a 92% e 92,5% a 18ºC;

O ácido clorídrico é um ácido forte
- 5 % > α > 50%: ácido semiforte.
Exemplos: A 18ºC, temos o H2SO3 (α = 30%), o H3PO4 (α = 27%) e o HF (α = 8,5%);
- α < 5%: ácido fraco.
Exemplos: A 18ºC, temos o H2S (α = 0,076%), o H3BO3 (α = 0,075%) e o HCN (α = 0,008%).
Mais um critério usado para se classificar os ácidos e que é importante para garantir a segurança:
-
De acordo com a volatilidade (ponto de ebulição):
- Fixos: seu ponto de ebulição é superior a 100ºC e, em temperatura ambiente, passam muito lentamente para o estado de vapor. Exemplos: H2SO4 (340ºC) e H3PO4 (213ºC);
- Voláteis: seu ponto de ebulição é inferior a 100ºC e, em temperatura ambiente, passam facilmente para o estado de vapor. Exemplos: HCl (-85ºC) e H2S (-59,6ºC).
Os ácidos voláteis liberam vapores tóxicos e, por isso, devem ser manuseados em uma capela que aspira esses vapores.
Por Jennifer Fogaça
Graduada em Química
Aproveite para conferir nossa videoaula sobre o assunto: