Dissociação das bases
A dissociação das bases é um fenômeno de liberação de íons, relacionado ao grau de ionização dessas substâncias em água ou quando fundidas.
Por Diogo Lopes Dias

PUBLICIDADE
A dissociação das bases, segundo a teoria de Arrhenius, é um fenômeno que ocorre com essas substâncias apenas em duas situações pontuais: quando são colocadas em água ou quando são submetidas ao processo de fusão (passagem do estado sólido para o estado líquido).
O processo ou fenômeno da dissociação das bases é caracterizado pela liberação de íons, sendo um cátion Y+ qualquer sempre acompanhado do ânion hidróxido (OH-), e pode ser representado por uma equação genérica:
.jpg)
Equações genéricas de dissociação de uma base
Obs.: O símbolo Δ significa aquecimento, ou seja, nesse caso, a base está sofrendo fusão.
Veja a seguir alguns exemplos de equações de dissociação de bases:
1º Exemplo: dissociação da base hidróxido de sódio (NaOH)
Analisando a fórmula do hidróxido de sódio, verificamos a presença do metal sódio e de uma unidade do grupo hidroxila. Assim, quando essa base é dissociada, o metal sódio é liberado com a carga +1, e apenas 1 mol de ânion hidróxido, por haver um grupo OH na composição da base. A equação de dissociação dessa base é dada por:
.jpg)
Equação genérica de dissociação do NaOH
2º Exemplo: dissociação da base hidróxido de zinco [Zn(OH)2]
Analisando a fórmula do hidróxido de zinco, percebemos a presença do metal zinco e de duas unidades do grupo hidroxila. Assim, quando essa base é dissociada, o zinco é liberado com a carga +2, e 2 mol de ânion hidróxido, pois, nesse caso, há dois grupos OH na composição da base. A equação de dissociação dessa base é dada por:
2(2).jpg)
Equação genérica de dissociação do Zn(OH)2
3º Exemplo: dissociação da base hidróxido de ferro III [Fe(OH)3]
Analisando a fórmula do hidróxido de ferro III, verificamos a presença do metal ferro e de três unidades do grupo hidroxila. Assim, quando essa base é dissociada, o metal ferro é liberado com a carga +3, e 3 mol de ânion hidróxido, por haver três grupos OH na composição da base. A equação de dissociação dessa base é dada por:
3(2).jpg)
Equação genérica de dissociação do Fe(OH)3
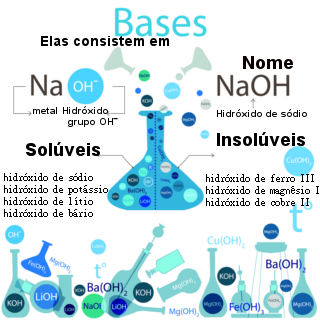
Vale ressaltar que a dissociação das bases é um fenômeno que está diretamente relacionado com a classificação dessas substâncias com relação à força (capacidade de dissociar em água ou quando fundidas) e à solubilidade em água (capacidade de dissolver em água). Assim:
-
Bases fortes (apresentam elementos das famílias IA ou IIA, com exceção do magnésio): são aquelas que dissociam muito, ou seja, liberam muitos íons.
As bases fortes possuem um grau de dissociação (α) maior ou igual a 5% e, geralmente, são solúveis em água, com exceção daquelas com elementos da família IIA (pouco solúveis).
-
Bases fracas: são aquelas que dissociam pouco, ou seja, liberam poucos íons.
As bases fracas apresentam um grau de dissociação menor que 5% e são praticamente insolúveis em água.
A seguir, saiba como determinar a dissociação de algumas bases, de acordo com a força e solubilidade em água.
1º Exemplo: hidróxido de bário [Ba(OH)2]
É uma base formada por elemento da família IIA, logo caracteriza-se por ser uma base forte e pouco solúvel em água. Por essa razão, é uma base com boa capacidade de dissociação.
2º Exemplo: hidróxido de estanho IV [Sn(OH)4]
É uma base formada por elemento da família IVA, portanto é uma base fraca e praticamente insolúvel em água. Por essa razão, é uma base com péssima capacidade de dissociação.
3º Exemplo: hidróxido de potássio (KOH)
É uma base formada por elemento da família IA, por isso é uma base forte e muito solúvel em água. Em razão disso, é uma base com excelente capacidade de dissociação.