Grau de hidratação dos ácidos
O estudo do grau de hidratação dos ácidos envolve as formas orto, piro e meta.
Por Diogo Lopes Dias

PUBLICIDADE
Ácidos são substâncias que estão relacionadas com o cotidiano do ser humano. Um exemplo disso é o ácido clorídrico (HCl), responsável por realizar a dissolução de alimentos no estômago, ou o ácido sulfúrico (H2SO4), presente na bateria de veículos automotores.
De acordo com o químico sueco Svante August Arrhenius, os ácidos possuem a capacidade de ionizar (produzir íons em solução aquosa) em água, produzindo como único cátion o hidrônio, (H3O+). Abaixo temos um exemplo de ionização, utilizando o ácido bromídrico:
HBr + H2O → H3O+(aq) + Br(aq)
Muitas são as suas características (força, solubilidade, volatilidade, instabilidade, presença de oxigênio), cada qual com a sua importância, porém neste texto vamos dar ênfase para o grau de hidratação que essas substâncias podem apresentar, que só é aplicado como característica para alguns oxiácidos (ácidos que apresentam na sua constituição átomos de oxigênio). Segue abaixo alguns exemplos de oxiácidos:
-
H3BO3 (ácido bórico)
-
H3PO4 (ácido fosfórico)
-
H4SiO4 (ácido silícico)
-
H3ASO4 (ácido arsênico)
O grau de hidratação é um fator que está relacionado com a quantidade de moléculas de água (H2O) que podem ser retiradas da fórmula de um ácido. Como os ácidos de Arrehnius apresentam o elemento hidrogênio em sua composição, para tratar dessa característica é necessária a presença de átomo ou átomos de oxigênio na composição do ácido.
Para classificar os ácidos quanto à hidratação, são utilizados três termos diferentes (orto, piro e meta) os quais devem fazer parte da nomenclatura do ácido. As características de cada um deles são demonstradas a seguir:
a) Ácido orto
É o oxiácido que apresenta o maior grau de hidratação possível. Ele é, inclusive, o ácido que dá origem aos ácidos piro e meta. Vale ressaltar que como o ácido orto é aquele que origina os outros tipos quanto ao grau de hidratação, o termo orto é opcional na nomenclatura dele. Exemplo:
H3PO4 (ácido fosfórico ou ortofosfórico)
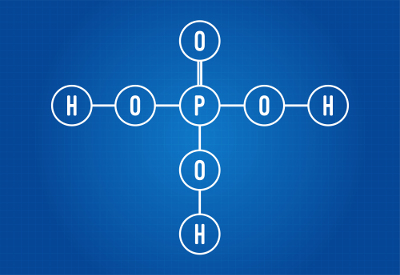
Fórmula molecular do ácido fosfórico
b) Ácido piro
É o oxiácido que apresenta um grau de hidratação intermediário, ou seja, apresenta mais moléculas de água que o ácido meta e menos que o ácido orto. Ele é obtido através da retirada de uma molécula de água de duas moléculas de ácido orto.
Assim, para formar um ácido piro, basta multiplicarmos a forma do orto por dois e em seguida retirar uma molécula de água. Veja o exemplo:
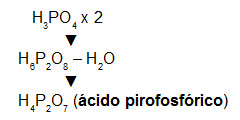
Formação do ácido pirofosfórico
Observação: Podemos ainda definir que a origem do ácido meta se dá por desidratação intermolecular, pelo fato da molécula de água ser retirada após a interação de duas moléculas do ácido orto de origem.
c) Ácido meta
É o oxiácido que apresenta o menor grau de hidratação. Ele é obtido a partir da retirada de uma molécula de água de um ácido orto. Por exemplo:
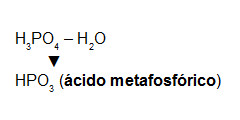
Formação do ácido metafosfórico
Observação: Podemos ainda definir que a origem do ácido meta se dá por desidratação intramolecular, já que a molécula de água é retirada do próprio ácido orto de origem.
Por Me. Diogo Lopes Dias