Grau de ionização dos ácidos
O grau de ionização dos ácidos (?) indica a força dessas substâncias, sendo a relação entre as moléculas que efetivamente se ionizaram e as moléculas que foram dissolvidas.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
Os ácidos, segundo a teoria de dissociação eletrolítica de Arrhenius, são aquelas substâncias que, em meio aquoso, reagem com a água, sofrendo ionização e liberando como único cátion o hidrogênio (H+) ou, mais corretamente, o cátion hidrônio (H3O+):
HA(aq)→ H+(aq) + A-(aq)
ou
HA + H2O → H3O+(aq) + A-(aq)
Geralmente, quando a palavra “ácido” é usada no cotidiano, ela remete à ideia de algo corrosivo e tóxico. Existem realmente ácidos assim, como é o caso do ácido clorídrico (HCl) usado em limpezas pesadas, sendo conhecido comercialmente como ácido muriático, e o ácido sulfúrico (H2SO4) presente nas baterias dos automóveis. Esses ácidos são considerados como fortes.
Mas existem também ácidos fracos, como o ácido bórico (H3BO3), que é usado em colírios em razão de sua ação antisséptica.
No entanto, não podemos classificar um ácido como forte ou fraco somente com base no mal que ele pode ou não nos causar, pois o próprio ácido bórico é também usado em inseticidas para matar baratas e formigas, e o ácido cianídrico (HCN), que é um ácido fraco, libera um gás extremamente tóxico que era usado em câmaras de execução de pessoas nos Estados Unidos.
Então, como determinamos a força dos ácidos?
Por meio do seu grau de ionização simbolizado por α.
“O grau de ionização (α) é a porcentagem de moléculas do ácido dissolvido em água que efetivamente sofreram ionização.”
Seu cálculo é feito pela relação entre a quantidade de moléculas que se ionizaram e a quantidade total de moléculas que foram dissolvidas:
α = número de moléculas que se ionizaram
número total de moléculas que foram dissolvidas
Por exemplo, quando dissolvemos 1000 moléculas do ácido clorídrico (HCl) em água, a 18 ºC, 925 delas sofrem ionização, o que é uma quantidade grande e, por isso, ele é considerado um ácido forte. Dizemos que seu grau de ionização é igual a 92,5%.
Por outro lado, quando dissolvemos 1000 moléculas do ácido bórico (H3BO3), a 18 ºC, apenas 75 delas sofrem ionização, um valor muito pequeno. O grau de ionização do ácido bórico (H3BO3) é, portanto, 0,075%, sendo por isso considerado um ácido fraco.
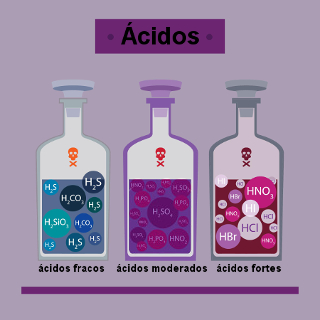
Assim, basta calcular o grau de ionização dos ácidos e fazer a seguinte associação para classificá-los como fortes, moderados ou fracos:

A força dos ácidos é dada pelo grau de ionização
Veja mais alguns exemplos de ácidos fortes, moderados e fracos, e o valor dos seus respectivos graus de ionização:
Ácidos fortes:
- Ácido nítrico (HNO3): α = 92%;
- Ácido sulfúrico (H2SO4): α = 61%.
Ácidos moderados:
- Ácido sulfuroso (H2SO3): α = 30%;
- Ácido fosfórico (H3PO4): α = 27%;
- Ácido florídrico (HF): α = 8,5%.
Ácidos fracos:
- Ácido sulfídrico (H2S): α = 0,076%;
- Ácido cianídrico (HCN): α = 0,008%.
Por Jennifer Fogaça
Graduada em Química