Hidróxido de sódio (soda cáustica)
O hidróxido de sódio (NaOH), conhecido como soda cáustica, é um importante reagente inorgânico usado na fabricação do papel e do sabão.
Por Stéfano Araújo Novais

PUBLICIDADE
O hidróxido de sódio (NaOH) é um composto inorgânico, bastante utilizado no cotidiano da Química, vendido comercialmente como soda cáustica. Entre suas características marcantes, estão a forte solução alcalina formada após dissolução em água, a grande liberação de energia durante sua dissolução em água e sua higroscopicidade.
O hidróxido de sódio é utilizado amplamente na indústria do papel, assim como na fabricação de sabão. Embora, por muitos anos, tenha sido produzido do carbonato de cálcio, atualmente, a sua principal forma de produção é por eletrólise aquosa de solução de cloreto de sódio.
Leia também: Amônia (NH3) — um gás incolor de odor forte e característico e de caráter básico
Resumo sobre hidróxido de sódio
- O hidróxido de sódio (NaOH) é um composto inorgânico conhecido como soda cáustica.
- Quando dissolvido em água, além de liberar bastante energia na forma de calor, forma uma solução altamente alcalina.
- Tem a capacidade de reter a umidade presente no ar, em uma propriedade conhecida como higroscopia.
- É empregado na fabricação do papel e do sabão.
- É majoritariamente produzido pela eletrólise aquosa do cloreto de sódio.
- Exige cuidado em sua manipulação, uma vez que é altamente corrosivo.
O que é hidróxido de sódio?
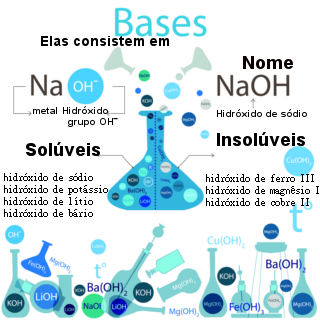
O hidróxido de sódio é um composto inorgânico, de fórmula NaOH e comercialmente conhecido como soda cáustica. Pelo seu típico caráter alcalino em solução aquosa, o hidróxido de sódio é comumente classificado como uma base.
Características do hidróxido de sódio
O hidróxido de sódio, na sua forma sólida, apresenta coloração branca, é quebradiço, mas com certa transparência. Algumas propriedades físicas básicas estão na tabela a seguir:
|
Massa molar (g.mol−1) |
39,997 |
|
Ponto de fusão (°C) |
323 |
|
Ponto de ebulição (°C) |
1388 |
|
Densidade (g.cm−3) |
2,13 |
|
Solubilidade em água (g/100 g H2O) |
100 |
|
É solúvel também em |
etanol e metanol |
Sua ação corrosiva sobre a pele humana fez com que fosse chamado de soda cáustica. Apesar de ser produzido na forma de um sólido anidro, é utilizado na forma de uma solução aquosa na maioria das vezes.
Uma característica muito chamativa do hidróxido de sódio é a deliquescência (ou higroscopia), que consiste na absorção da umidade presente no ar, dissolvendo-se. Contudo, a absorção de gás carbônio também presente no ar faz com que a solução se solidifique novamente, via formação de carbonato de sódio na superfície.
Durante a dissolução do hidróxido de sódio em água, há a formação de calor, configurando-se uma dissolução exotérmica, o que exige cuidado durante o processo.
Para que serve o hidróxido de sódio?

Entre os principais usos do hidróxido de sódio, estão a sua utilização na indústria de papel, na fabricação de substâncias inorgânicas e orgânicas, além da extração da alumina da bauxita, um dos principais minérios na confecção do mineral alumínio.
Na indústria de papel, o hidróxido de sódio é utilizado durante a polpação, separando a lignina das fibras de celulose, no chamado Processo Kraft. Nesse processo, em conjunto com o sulfeto de sódio, o hidróxido de sódio forma uma solução chamada de licor branco, que, em conjunto com aparas de madeira, dissolve a lignina, permitindo a liberação das fibras celulósicas. Depois, essa lignina é ainda separada da massa, durante a deslignificação, na presença de gás oxigênio e hidróxido de sódio.
O hidróxido de sódio é utilizado na fabricação da água sanitária e na indústria do petróleo para sua produção e processamento, removendo substâncias que causam mal odor, como sulfeto de hidrogênio e mercaptanas.
Além disso, ele é utilizado como matéria-prima de diversos produtos, tais como plásticos, solventes, adesivos, revestimentos, herbicidas, tintas, pigmentos e medicamentos.
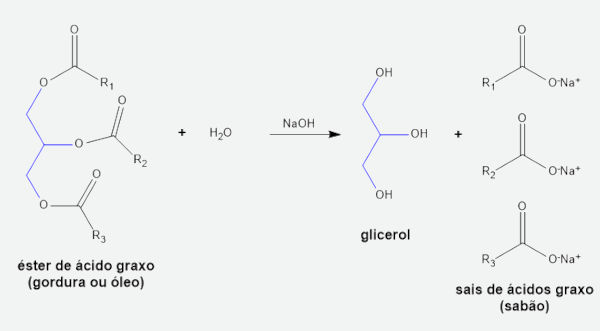
O hidróxido de sódio também é empregado na fabricação de sabão, sendo um dos reagentes da reação de saponificação, que converte gordura vegetal ou animal em sabão.
Onde o hidróxido de sódio é encontrado?
O hidróxido de sódio é, na verdade, produzido por meio de processos industriais, pois não é encontrado na natureza. A principal forma de produção se dá pela eletrólise aquosa do sal de cozinha, cloreto de sódio.
2 NaCl + 2 H2O → H2 + Cl2 + 2 NaOH
Nesse processo, o ânodo, o eletrodo em que ocorre a oxidação, recebe os íons cloro provenientes no NaCl, produzindo, assim, gás cloro:
2 Cl− → Cl2 + 2 e−
Já o cátodo, eletrodo em que ocorre a redução, recebe os íons H+ provenientes da água, produzindo o gás hidrogênio:
2 H+ + 2 e− → H2
Assim, a solução fica rica nos íons sódio e hidróxido, configurando uma solução de NaOH.
Também é possível a produção de hidróxido de sódio do carbonato de sódio, Na2CO3, com óxido de cálcio e água, em um processo conhecido como caustificação.
Na2CO3 + CaO + H2O → 2 NaOH + CaCO3
Reações do hidróxido de sódio
→ Reação do hidróxido de sódio na água
Quando dissolvido em água, o hidróxido de sódio forma uma solução altamente alcalina, proveniente do seu elevado grau de dissociação:
NaOH (s) → Na+ (aq) + OH− (aq)
→ Reação do hidróxido de sódio com ácido
Não à toa, o hidróxido de sódio pode ser utilizado em reações com ácidos (reações de neutralização) para formar sais de sódio. Um exemplo é a formação do sulfato de sódio:
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Apresentando um caráter alcalino em solução aquosa, é sempre esperado, então, que o NaOH reaja com espécies de caráter ácido, seja esse caráter forte, seja fraco.
→ Reação do hidróxido de sódio com metais e óxidos anfóteros
O hidróxido de sódio também pode reagir com metais e óxidos anfóteros, que se comportam como ácido nessa ocasião. Nas reações serão formados ânions complexos, como AlO2−, ZnO22− e SnO32−, tendo H2 como subproduto (quando da reação com metais) ou H2O (quando da reação com óxidos).
O maior exemplo é a reação com o hidróxido de alumínio, no começo da extração da alumina a partir da bauxita.
Al(OH)3 + NaOH → NaAlO2 + 2 H2O
→ Reação do hidróxido de sódio com ácido carboxílico
No campo da Química orgânica, o hidróxido de sódio pode reagir com ácidos carboxílicos para formar sais orgânicos solúveis. Uma reação de interesse dentro desse campo é a de hidrólise básica, conhecida como saponificação. Nessa reação, um éster de ácido graxo (triglicerídeos) reage com uma solução aquosa de hidróxido de sódio para a formação de sabão e glicerol (um triálcool) como subproduto.
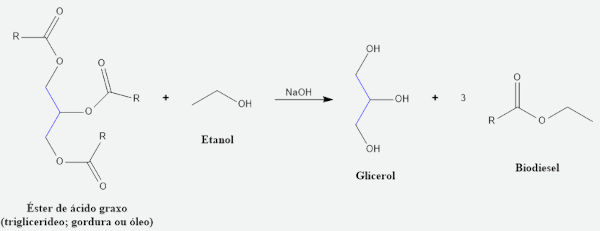
→ Reação do hidróxido de sódio na produção de biodiesel
O hidróxido de sódio também é o meio utilizado para a produção de biodiesel, processo chamado de transesterificação. Tal reação exige que não seja utilizada água, mas sim um álcool de baixa massa molar, como metanol ou etanol, para reagir com o éster e assim formar o biodiesel. A reação ocorre com a utilização de uma base forte, como hidróxido de sódio.
Perigos do hidróxido de sódio
De modo geral, existem alguns perigos inerentes à utilização do hidróxido de sódio. O primeiro deles é em relação ao calor liberado na sua dissolução em água. Para concentrações acima de 40% em massa, a energia produzida pode ser suficiente para fazer materiais combustíveis entrarem em ignição. Na reação com ácidos também há grande liberação de calor, o que pode fazer a solução “saltar” do frasco. Há de se atentar ainda para a formação de gás hidrogênio, altamente inflamável, durante a reação com metais como alumínio, estanho e zinco.
Outra questão é que o hidróxido de sódio é altamente corrosivo, gerando uma irritação intensa por qualquer via de exposição (inalação, ingestão, contato com a pele ou com os olhos). As queimaduras por hidróxido de sódio são possíveis, uma vez que ele pode absorver a umidade presente no corpo e então liberar uma grande quantidade de calor. A ingestão pode ainda desencadear em úlceras gástricas.
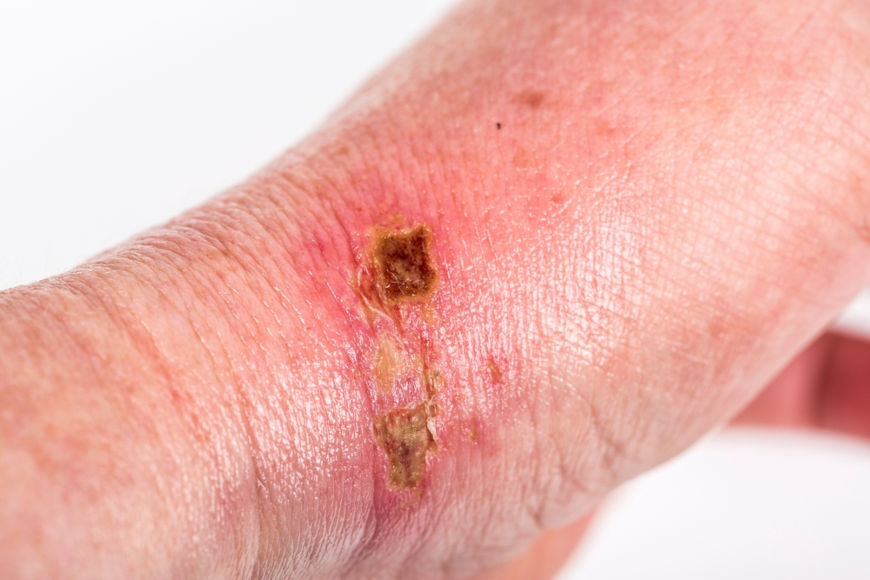
Acesse também: Ácido sulfúrico — um ácido forte, extremamente corrosivo e oxidante
História do hidróxido de sódio
Embora existam relatos de que civilizações antigas, como os egípcios e os romanos, utilizavam soluções de hidróxido de sódio (a partir de cinzas de plantas) para produção de sabão, foi apenas no século XIX que se iniciaram as formas de produção de soda cáustica.
Em 1820, o químico francês Jean-Antoine Chaptal descobriu um processo que produziria hidróxido de sódio pelo tratamento do carbonato de sódio com hidróxido de cálcio, em algo conhecido como Processo Chaptal. Em 1853, outro cientista francês, Nicolas LeBlanc, desenvolveu o Processo LeBlanc, que consistia na fabricação de hidróxido de sódio a partir do sal marinho.
Nesse processo, o cloreto de sódio era convertido em sulfato de sódio, o qual era calcinado em conjunto com o carvão, produzindo a barrilha (carbonato de sódio). Esse carbonato de sódio era então caustificado com hidróxido de cálcio, formando o hidróxido de sódio em solução.
Na2CO3 + Ca(OH)2 → 2 NaOH + CaCO3
A vantagem desse método é que o carbonato de cálcio é muito pouco solúvel em água, deixando a solução resultante sendo quase completamente de hidróxido de sódio.
Em 1861, surgiu o processo amônia-soda, feito por Ernest Solvay, que permitia a produção de carbonato de sódio mais puro, o qual era a principal fonte de hidróxido de sódio à época. A dependência do carbonato de sódio para produção de soda cáustica só teve fim com o desenvolvimento da produção do hidróxido de sódio via eletrólise, em 1890. O método, já conhecido à época, foi se aperfeiçoando.
Na segunda metade do século XX, começou a produção de hidróxido de sódio via eletrólise, o que praticamente sepultou a produção via carbonato de sódio.
Exercícios resolvidos sobre hidróxido de sódio
Questão 1
(Uece) O hidróxido de sódio, NaOH, é muito usado industrialmente para a produção de compostos, como sabão, papel e celulose. É usado na purificação de óleos vegetais e também na fabricação de produtos para desentupir ralos de pias.
Considerando-se a introdução de algumas pastilhas de NaOH em um recipiente contendo água destilada, é correto afirmar que
A) o pH da solução aumenta.
B) a concentração de íons H+ se eleva.
C) o NaOH dissocia-se porque é uma base fraca.
D) o NaOH reage e forma cristais de sais.
Resolução:
Alternativa A.
O hidróxido de sódio (NaOH) apresenta caráter alcalino ao se dissolver em água, aumentando a concentração dos íons hidróxido. Como consequência, o pH da solução aumenta, uma vez que o pOH aumenta.
Questão 2
(Fema) Em um dado experimento, foram colocados pedaços de papel alumínio em uma solução aquosa de hidróxido de sódio e observou-se a formação de um gás em volta do papel alumínio até o seu desaparecimento, ao mesmo tempo houve um aquecimento da vidraria na qual se fazia o experimento.
Com base nesta reação, a fórmula molecular do gás liberado e o tipo de reação, são respectivamente:
A) H2 e endotérmica
B) O2 e endotérmica
C) O2 e exotérmica
D) CO2 e exotérmica
E) H2 e exotérmica
Resolução:
Alternativa E.
As reações de uma solução aquosa de hidróxido de sódio com metais como alumínio, zinco e estanho são altamente exotérmicas. Além disso, ocorre a seguinte reação:
Al + NaOH + H2O → NaAlO2 + H2
Comprovando que o gás liberado é o H2.
Fontes
CAUSTIC SODA PEARL. The History of Caustic Soda Pearl: From Ancient Origins to Modern Applications. Caustic Soda Pearl. Disponível em: https://www.causticsodapearl.co.uk/pages/the-history-of-caustic-soda-pearl-from-ancient-origins-to-modern-applications.
EGGEMAN, T. Sodium Hydroxide. In: Kirk-Othmer Encyclopedia of Chemical Terminology. EUA: John Wiley & Sons, 2001.
GRUPO PCC. Indústria de cellulose e papel. PCC Group. 24 set. 2020. Disponível em: https://www.products.pcc.eu/pt/k/industria-de-celulose-e-papel/.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.
SALOCKS, C.; KALEY, K. B. Technical Support Document: Toxicology Clandestine Drug Labs: Metamphetamine. Office of Environmental Health Hazard Assessment. V. 1, n. 7, 24 set. 2003.
SILVA, I. M. C. B. Hidróxido de Sódio (CAS No. 1310-73-2). Revista Virtual de Química. mar. 2012. v. 4, n. 1.