Nomenclatura das bases
A nomenclatura das bases que possuem o cátion com somente uma valência é realizada escrevendo-se a palavra “hidróxido de” e o nome do cátion.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
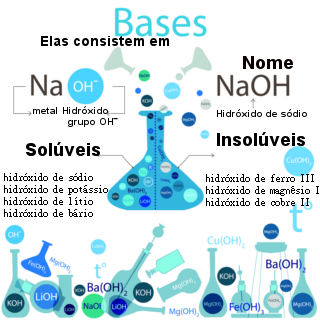
As bases são compostos inorgânicos que, em meio aquoso, liberam como único ânion o hidróxido (OH-), e seus cátions variam, sendo, geralmente, metais.
A nomenclatura desses compostos baseia-se nessa sua formação, em que sempre se escreve primeiro “hidróxido de” seguido do nome do cátion.

Nomenclatura das bases com uma valência
Veja alguns exemplos:
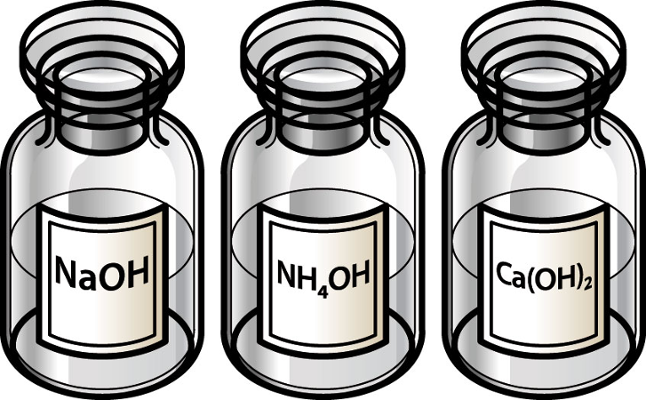
NaOH: Hidróxido de sódio
Ca(OH)2: Hidróxido de cálcio
Al(OH)3: Hidróxido de Alumínio
AgOH: Hidróxido de prata
NH4OH: Hidróxido de Amônio
Zn(OH)2: Hidróxido de zinco
No entanto, essa regra aplica-se somente no caso de bases em que seus cátions só possuem uma eletrovalência, isto é, uma única carga. Mas existem aqueles casos em que os cátions podem apresentar mais de uma eletrovalência e formar bases diferentes, como é o caso do ferro, que pode perder dois ou três elétrons, formando, respectivamente, os cátions Fe2+ e Fe3+ e as bases Fe(OH)2 e Fe(OH)3.
Nesse tipo de caso, a nomenclatura pode acontecer de duas formas:
(1) Acrescenta-se o algarismo romano que indica o número da carga. Assim, no caso do ferro, teríamos:
Fe(OH)2: Hidróxido de ferro II
Fe(OH)3: Hidróxido de ferro III
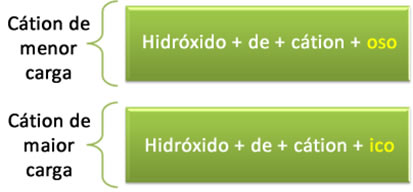
(2) Acrescenta-se o sufixo “oso” para o cátion de menor carga e o sufixo “ico” para o sufixo que tiver maior carga:
Nomenclatura das bases de duas valências
No caso das bases do ferro, temos:
Fe(OH)2: Hidróxido ferroso
Fe(OH)3: Hidróxido férrico
Outros exemplos:
Sn(OH)2: Hidróxido de estanho II ou Hidróxido estanoso
Sn(OH)4: Hidróxido de estanho IV ou Hidróxido estânico
Cu(OH)2: Hidróxido de cobre II ou Hidróxido cúprico
CuOH: Hidróxido de cobre I ou Hidróxido cuproso
Por Jennifer Fogaça
Graduada em Química
Aproveite pra conferir nossas videoaulas sobre o assunto: