Nomenclatura dos óxidos
A nomenclatura dos óxidos segue as regras estabelecidas pela Iupac, indicando ou não o estado de oxidação do elemento combinado com o oxigênio.
Por Jhonilson Pereira Gonçalves
PUBLICIDADE
A nomenclatura dos óxidos segue regras específicas e depende da natureza do elemento ligado ao oxigênio e do número de oxigênios presentes. Os óxidos são compostos químicos formados pela combinação do oxigênio com outro elemento. Nesse sentido, por meio da nomenclatura sistemática fornecida pela Iupac, podemos classificá-los em diferentes categorias dependendo da natureza dos elementos envolvidos e da quantidade de oxigênio presente.
Leia também: Como são classificados os óxidos
Resumo sobre nomenclatura dos óxidos
- A nomenclatura dos óxidos facilita identificação e indica suas propriedades.
- Óxidos são compostos de oxigênio com outros elementos.
- A classificação dos óxidos varia de acordo com a natureza do elemento ligado ao oxigênio.
- Os óxidos podem ser classificados como:
- óxidos básicos: reagem com água, formando bases;
- óxidos ácidos: reagem com água, formando ácidos;
- óxidos anfóteros: reagem com ácidos ou bases;
- óxidos peróxidos: contêm a espécie peróxido (O22-);
- óxidos neutros: não reagem significativamente com ácidos ou bases.
Como é feita a nomenclatura dos óxidos
A nomenclatura dos óxidos varia dependendo do tipo de elemento que está combinado com o oxigênio no composto. Sendo assim, neste tópico veremos cada caso separadamente:
→ Nomenclatura de óxidos metálicos com apenas um estado de oxidação
Quando o oxigênio estiver ligado a um metal, segue-se a seguinte regra geral:
Óxido de + nome do metal
Exemplos:
Na2O -- óxido de sódio
MgO -- óxido de magnésio
Al2O3 -- óxido de alumínio
→ Nomenclatura de óxidos de elementos com dois estados de oxidação
Nesse caso, a nomenclatura pode ser feita de duas formas:
- 1º método: escreve-se o nome óxido seguido do nome do elemento ligado ao oxigênio, contudo, dependendo do número de oxidação (Nox) desse elemento, é necessário substituir a última letra do nome do por ico ou oso. Dessa forma, a regra geral fica assim:

Exemplo 1:
O ferro (Fe) apresenta apenas dois estados de oxidação: 2+ e 3+. Sendo assim, vejamos como ficam os nomes dos compostos a seguir:
|
Nox: 3+ |
Nox: 2+ |
|
Fe2O3 – Óxido férrico |
FeO – Óxido ferroso |
Exemplo 2:
O cobre (Cu) também tem apenas dois estados de oxidação: 1+ e 2+.
|
Nox: 2+ |
Nox: 1+ |
|
CuO – óxido cúprico |
Cu2O – óxido cuproso |
- 2º método: este é mais simples, uma vez que basta saber o Nox dos metais nos compostos formados e seguir da seguinte forma:
Óxido de + nome do metal + (Nox dentro dos parênteses, escrito em algarismos romanos)
Exemplo 1:
|
Fe2O3 |
Nox: 3+ |
FeO |
Nox: 2+ |
|
óxido férrico |
óxido ferroso |
||
|
óxido de ferro (III) |
óxido de ferro (II) |
Exemplo 2:
|
CuO |
Nox: 2+ |
Cu2O |
Nox: 1+ |
|
óxido cúprico |
óxido cúproso |
||
|
óxido de cobre (II) |
óxido de cobre (I) |
Esta última regra é aplicada nos casos em que os óxidos são formados por elementos metálicos com múltiplos estados de oxidação:
|
Compostos |
Nox |
Nomes |
|
MnO2 |
+4 |
óxido de manganês (IV) |
|
Mn2O3 |
+6 |
óxido de manganês (VI) |
|
Mn2O7 |
+7 |
óxido de manganês (VII) |
Outro exemplo é o cromo (Cr):
|
Compostos |
Nox |
Nomes |
|
CrO |
+2 |
óxido de cromo (II) |
|
Cr2O3 |
+3 |
óxido de cromo (III) |
|
CrO2 |
+4 |
óxido de cromo (IV) |
|
CrO3 |
+6 |
óxido de cromo (VI) |
→ Nomenclatura de óxidos não metálicos (óxidos ácidos ou anidridos)
Nesse caso, basta escrever a palavra óxido seguido do nome do elemento:
Óxido de + nome do ametal
Obs.: Indica-se, com o uso de prefixos, a quantidade de cada elemento no composto.
Exemplos:
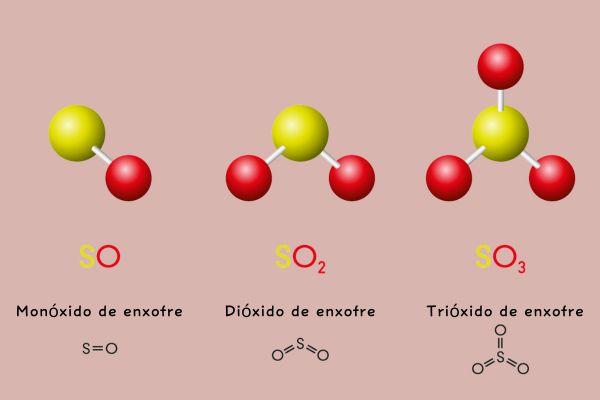
CO – monóxido de carbono
CO2dióxido de carbono
SO2 – dióxido de enxofre
SO3 – trióxido de enxofre
N2O – monóxido de dinitrogênio
N2O5 – pentóxido de dinitrogênio
Essa regra também pode ser aplicada aos óxidos metálicos com mais de uma valência:
Exemplo: Fe2O3 – trióxido de diferro
Saiba mais: O que são superóxidos?
Classificação dos óxidos
Os óxidos podem ser classificados como básicos, ácidos, anfóteros, peróxidos ou neutros. Sendo assim, vamos ver como ocorrem em cada caso:
- Óxidos básicos: reagem com água para formar bases.
Exemplos:
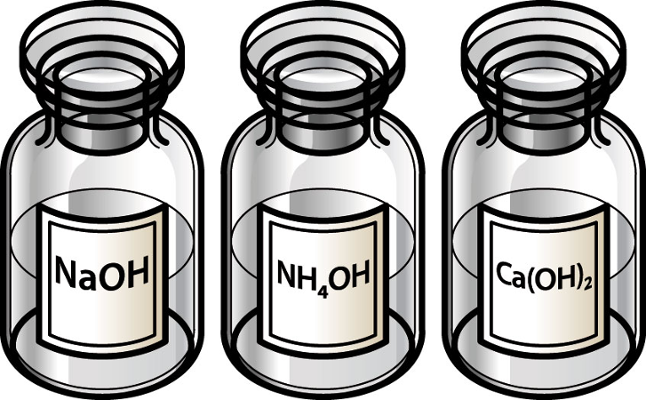
Na2O - óxido de sódio + água = hidróxido de sódio: Na2O + H2O → 2NaOH
MgO - óxido de magnésio + água = hidróxido de magnésio: MgO + H2O → Mg(OH)
CaO - óxido de cálcio + água: hidróxido de cálcio: CaO + H2O → Ca(OH)2
Como você deve ter percebido, são óxidos básicos formados por oxigênio-metal: Parte superior do formulário
K2O, Al2O3, CuO etc.
- Óxidos ácidos: reagem com água para formar ácidos.
Exemplos:
CO2 - dióxido de carbono + água = ácido carbônico: CO2 + H2O → H2CO3
SO2 - dióxido de enxofre + água = ácido sulfúrico: SO2 + H2O → H2SO3
NO2 - dióxido de nitrogênio + água = ácido nítrico: NO2 + H2O → HNO3
Geralmente são caracterizados pela composição oxigênio-ametal: P4O5, Cl2O7 etc.
- Óxidos anfóteros: podem reagir tanto com ácidos quanto com bases.
Exemplos:
Al2O3 - óxido de alumínio:
Reação com ácido: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Reação com base: Al2O3 + 2NaOH + 3H2O → 2NaAl(OH)4
ZnO - óxido de zinco:
Reação com ácido: ZnO + 2HCl → ZnCl2 + H2O
Reação com base: ZnO + 2NaOH → Na2ZnO2 + H2O
Outros exemplos desses óxidos são: PbO, Cr2O3, PbO, SnO2 etc.
- Óxidos peróxidos: contêm a espécie peróxido (O22− ).
Exemplos:
H2O2 - peróxido de hidrogênio
Na2O2 - peróxido de sódio
BaO2 - peróxido de bário
CaO2 - peróxido de cálcio
MgO2 - peróxido de magnésio
- Óxidos neutros: não reagem com água para formar ácidos ou bases.
Exemplos:
N2O - óxido nitroso
CO - monóxido de carbono
SiO2 - dióxido de silício
NO - monóxido de nitrogênio
Por fim, vale ressaltar a importância de se conhecer as regras de nomenclatura dos óxidos, bem como suas formas de classificação, uma vez que nomes específicos e padronizados para cada composto evitam ambiguidades e confusões na comunicação científica.
→ Videoaula sobre a classificação dos óxidos
Exercícios resolvidos sobre a nomenclatura dos óxidos
1) Durante uma pesquisa sobre poluição atmosférica, foi identificado um gás incolor e altamente tóxico liberado em ambientes urbanos devido à queima de combustíveis fósseis. Esse gás, cuja fórmula molecular é NO, é um dos principais responsáveis pelos problemas respiratórios relacionados à qualidade do ar. Diante disso, responda: qual é a nomenclatura correta desse óxido?
a) Óxido de carbono (II)
b) Dióxido de carbono
c) Óxido de enxofre (IV)
d) Monóxido de nitrogênio
e) Óxido de nitrogênio (V)
Gabarito: d
“NO” é a fórmula molecular do monóxido de nitrogênio.
2) Durante uma aula prática de laboratório, um estudante obteve um sólido avermelhado (Fe2O3) ao realizar uma reação química com um metal. Esse sólido é um óxido comumente encontrado em minérios de ferro e tem propriedades magnéticas. Qual é a nomenclatura correta dele?
a) Óxido ferroso
b) Óxido de ferro (III)
c) Trióxido de ferro
d) Óxido de ferro (IV)
e) Óxido de ferro (II)
Gabarito: b
O ferro no Fe2O3 tem estado de oxidação +3, logo, sua possível nomenclatura seria: óxido de ferro (III) ou óxido férrico.
Fontes
BELÉM, G. C. B.; ALVES, J. A. Apostila de Química. Varginha, CEFET-MG, 2017. Disponível em: https://www.varginha.cefetmg.br/wp-content/uploads/sites/11/2016/11/Apostila-Química.pdf
COX, T. BIOS Instant Notes in Inorganic Chemistry. [s.l.] Taylor & Francis, 2004.
L. BROWN, T. et al. Óxidos. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 1007–1009.