Peróxidos
Os peróxidos são uma subclasse dos óxidos e apresentam compostos binários com oxigênio que são capazes de reagir com água e ácidos.
Por Diogo Lopes Dias
PUBLICIDADE
Os peróxidos são uma classe dos óxidos composta por substâncias binárias, isto é, formadas por dois elementos químicos diferentes. Um desses elementos que compõem os peróxidos é obrigatoriamente o oxigênio.
O elemento químico que acompanha o oxigênio na composição do peróxido é de natureza metálica (com exceção do peróxido de hidrogênio) e deve ser um dos relacionados a seguir:
-
Metais alcalinos (família IA)
-
Metais alcalinoterrosos (família IIA)
-
Zinco (Zn)
-
Prata (Ag)
A principal característica que um peróxido apresenta é o fato de o oxigênio possuir sempre NOX -1, independentemente do elemento que está acompanhando.
Características dos peróxidos
-
Apresentam natureza iônica (formados por ligação iônica), com exceção do peróxido de hidrogênio;
-
Com exceção do peróxido de hidrogênio, que é líquido em temperatura ambiente, todos os outros peróxidos são sólidos nessa temperatura;
-
Por causa da natureza iônica, apresentam característica básica quando participam de uma reação química;
-
São compostos relativamente instáveis, podendo sofrer decomposição e formar o gás oxigênio.
Nomenclatura dos peróxidos
A regra de nomenclatura utilizada para nomear um peróxido é:
Peróxido + de + nome do elemento que acompanha o oxigênio
Veja alguns exemplos de aplicação da regra de nomenclatura dos peróxidos:
Exemplo 1: ZnO2
Como esse peróxido apresenta o elemento zinco em sua composição, seu nome é peróxido de zinco.
Exemplo 2: BaO2
Como esse peróxido apresenta o elemento bário em sua composição, seu nome é peróxido de bário.
Exemplo 3: K2O2
Como esse peróxido apresenta o elemento potássio em sua composição, seu nome é peróxido de potássio.
Reações químicas envolvendo os peróxidos
Os peróxidos, com exceção do peróxido de hidrogênio, por apresentarem caráter básico, podem reagir com água e ácidos.
a) Reações de peróxidos com água
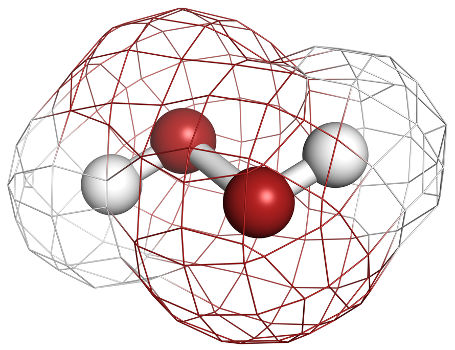
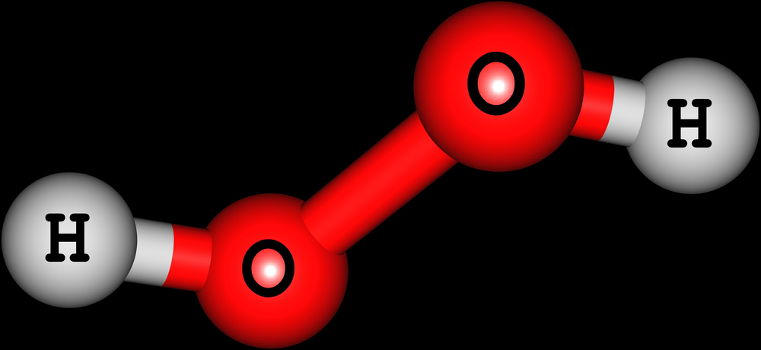
Quando um peróxido reage com a água, temos a formação de uma base inorgânica e o peróxido de hidrogênio (H2O2), como podemos observar nos exemplos a seguir:
Exemplo 1: Reação entre peróxido de sódio (Na2O2) e água
OBS.: O peróxido de sódio é utilizado para a descoloração de alguns tipos de papéis, deixando o produto branco.

Papéis que foram tratados com peróxido de sódio para branqueamento
K2O2 + 2 H2O → 2 KOH + H2O2
Nessa reação, temos a formação do cloreto de sódio (formado a partir do cátion do peróxido e do ânion do ácido) e peróxido de hidrogênio.
Como o peróxido de hidrogênio está em um meio básico, sofre decomposição, transformando-se em água e gás oxigênio.
H2O2 → ½ O2 + H2O
OBS.: Como temos duas moléculas de água no reagente da primeira equação e uma no produto da segunda equação, a molécula do produto anulará uma do reagente.
A reação química do peróxido de potássio na água pode ser escrita da seguinte forma:
K2O2 + 1H2O → 2 KOH + ½ O2
b) Reações de peróxidos com ácidos inorgânicos
Quando um peróxido reage com um ácido, temos a formação de um sal e o peróxido de hidrogênio (H2O2), como podemos observar nos exemplos a seguir:
Exemplo 1: Reação entre peróxido de sódio (Na2O2) e o ácido clorídrico (HCl)
Na2O2 + 2 HCl → 2 NaCl + H2O2
Nessa reação, temos a formação do cloreto de sódio (formado a partir do cátion do peróxido e do ânion do ácido) e peróxido de hidrogênio.
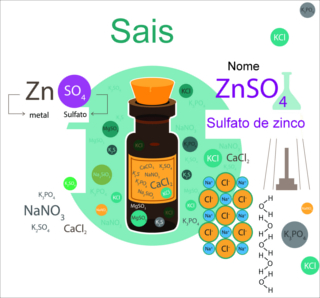
Exemplo 2: Reação entre peróxido de sódio (ZnO2) e o ácido clorídrico (H2SO4)
ZnO2 + H2SO4 → ZnSO4 + H2O2
Nessa reação, temos a formação do cloreto de sódio (formado a partir do cátion do peróxido e do ânion do ácido) e peróxido de hidrogênio.
Por Me. Diogo Lopes Dias
Videoaula relacionada: