Reações químicas
As reações químicas são os processos de conversão de uma espécie química em outra.
Por Stéfano Araújo Novais

PUBLICIDADE
As reações químicas são processos de conversão de uma ou mais espécies químicas em outras novas espécies químicas. Apesar de ocorrerem no mundo atômico, alterações em propriedades como odor, cor e sabor podem ajudar na comprovação da ocorrência de uma reação química.
Essas reações são regidas pelas leis ponderais, como a lei de Lavoisier e a lei de Proust. Ao equacionar uma reação química, devemos seguir tais leis e exercer o balanceamento correto dos participantes, de modo a não gerar análises quantitativas indevidas. Na Química Inorgânica, podemos definir quatro mecanismos de reação química: adição, decomposição, simples troca ou dupla troca.
Leia também: Ligações químicas — as ligações feitas por átomos para adquirir maior estabilidade
Resumo sobre reações químicas
- Uma reação química é um processo de interconversão de espécies químicas.
- A ocorrência de uma reação química pode ser identificada, também, por alterações em propriedades organolépticas, como cor, sabor e odor.
- As reações químicas são regidas pelas leis ponderais, as quais explicam o aspecto quantitativo das reações.
- Ao equacionar uma reação química, devemos fazer o devido balanceamento dos participantes, de modo a obedecer às leis ponderais.
- Na Química Inorgânica, conhecem-se quatro tipos de reações químicas: reações de adição (ou síntese), reações de decomposição (ou análise), reações de simples troca (ou deslocamento) e reações dupla troca (ou permutação).
- A compreensão das reações químicas é primordial para tudo que envolve a Química.
Videoaula sobre reações químicas
O que são reações químicas?
Segundo a União Internacional de Química Pura e Aplicada (Iupac), uma reação química é um processo que resulta na interconversão de espécies químicas.
Embora essa definição esteja atrelada a uma escala atômica, alguns fatores macroscópicos podem auxiliar na identificação de um processo químico, como a alteração em propriedades organolépticas, como cor, sabor e odor.

Podemos fazer a representação de uma reação química de forma simbólica, conforme mostrado a seguir:
REAGENTES → PRODUTOS
A representação simbólica de uma reação química é chamada de equação química.
→ Exemplos de reações químicas
- Decomposição térmica do carbonato de cálcio:
CaCO3 (s) → CaO (s) + CO2 (g)
- Combustão do metano:
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
- Síntese da amônia (Processo Haber-Bosch):
N2 (g) + 3 H2 (g) → 2 NH3 (g)
- Precipitação do cloreto de prata:
Ag+ (aq) + Cl- (aq) → AgCl (s)
Leis das reações químicas (ou leis ponderais)
As leis ponderais regem o aspecto quantitativo dos participantes de uma reação química. Veja a seguir as principais leis ponderais.
→ Lei da conservação de massas (lei de Lavoisier)
Segundo essa lei, se uma reação química ocorre em um recipiente fechado, a massa final dos produtos é exatamente igual à massa inicial dos reagentes. Assim, temos que:
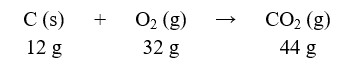
Perceba, no exemplo apresentado, que a massa de dióxido de carbono (CO2) formada é igual à massa dos reagentes (12 + 32).
Tal lei foi desenvolvida pelo químico francês Antoine Lavoisier, sendo frequentemente referenciada pela frase “na natureza nada se cria, nada se perde, tudo se transforma”.
→ Lei das proporções constantes (lei de Proust)
Definida por Joseph Proust, essa lei observa que as massas dos participantes de uma reação química sempre obedecerão a uma mesma proporção. Vejamos o exemplo a seguir:

Perceba que:
\(\frac{m_C}{m_{O2}}=\frac{12}{32}=\frac{24}{64}=\frac{36}{96}=\frac{187,5}{500}=0,375\)
Ou seja, quaisquer que sejam as massas de carbono e gás oxigênio que reagem, a proporção entre elas sempre será a mesma.
Balanceamento de reações químicas
A lei de Lavoisier deixa claro que uma reação química possui conservação de massa. Isso deve se repetir na hora de montarmos a reação, ou seja, é necessário deixar explícito que a quantidade de reagentes e produtos é a mesma. O processo que utilizamos para tal é conhecida como balanceamento da reação química.
Existe uma forma empírica para realizar o balanceamento de uma reação química em termos de quantidades, a chamada “regra do MACHO”, que estabelece uma ordem para o balanceamento:
- metais;
- ametais;
- carbono;
- hidrogênio;
- oxigênio.
Vejamos no exemplo da combustão do etanol:
C2H6O (l) + O2 (g) → CO2 (g) + H2O (g)
Nessa reação, não há nenhum metal e nenhum ametal diferente de carbono, hidrogênio e oxigênio. Segue então a ordem de carbono, depois hidrogênio e por último oxigênio.
- Há 2 carbonos do lado dos reagentes; deve-se então ter dois do lado dos produtos.
C2H6O + O2 → 2 CO2 + H2O
- Há 6 hidrogênios do lado dos reagentes; deve-se então ter 6 do lado dos produtos.
C2H6O + O2 → 2 CO2 + 3 H2O
- Há 7 oxigênios do lado dos produtos; deve-se então ter 7 do lado dos reagentes.
C2H6O + 3 O2 → 2 CO2 + 3 H2O
Como todos foram acertados, a reação está balanceada.
Tipos de reações químicas
No campo da Química Inorgânica, definimos quatro tipos de reações:
→ Reação de adição (ou síntese)
Na reação de adição (ou síntese), há a formação de um único produto, a partir de dois ou mais reagentes.
- Exemplo:
Combustão do gás hidrogênio:
2 H2 (g) + O2 (g) → 2 H2O (g)
→ Reação de decomposição (ou análise)
Na reação de decomposição (ou análise), há apenas um único reagente, com a formação de dois ou mais produtos.
- Exemplo:
Decomposição do dicromato de amônio:
(NH4)2Cr2O7 (s) → N2 (g) + Cr2O3 (s) + 4 H2O (g)
→ Reação de simples troca (ou deslocamento)
Na reação de simples troca (ou deslocamento), percebe-se que um reagente (uma substância simples) entra no lugar de um elemento presente em outro reagente (uma substância composta). Ou seja, um elemento é deslocado por outro durante o processo reacional.
- Exemplo:
Reação entre zinco e sulfato de cobre:
Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)

→ Reação de dupla troca (ou permutação)
Na reação de dupla troca (ou permutação), há a permutação entre os elementos químicos dos reagentes.
- Exemplo:
Precipitação do sulfato de bário a partir do cloreto de bário:
BaCl2 (aq) + H2SO4 (aq) → BaSO4 (s) + 2 HCl (aq)
Leia também: Reação de neutralização — a reação que ocorre entre um ácido e uma base
Importância das reações químicas
Entender reações químicas é entender o universo. A teoria do Big Bang, por exemplo, explica a formação dos elementos químicos que conhecemos por meio de reações químicas de fusão nuclear.
Não há indústria química sem a compreensão das reações químicas. Desenvolver novas rotas reacionais, buscando cada vez mais taxas de produção e cada vez menos custos, é um desafio diário para os pesquisadores da área de Química. Quando se conhece a reação química, é possível entender como melhorá-la, acelerá-la, inibi-la, enfim, exercer controles necessários.
Vale lembrar que a Química é a área da ciência que não só estuda a matéria, mas também as suas transformações.