Reações de simples troca com metais
As reações de simples de simples troca com metais envolvem o deslocamento do metal de uma substância composta por um metal de uma substância simples.
Por Diogo Lopes Dias

PUBLICIDADE
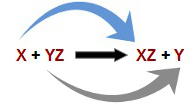
As chamadas reações químicas de simples troca podem ser denominadas ainda de reações de deslocamento. O princípio desses processos químicos é o de que um determinado átomo desloca outro átomo presente em certa substância composta, o que resulta em uma nova substância química. Veja um esquema geral de uma reação de simples troca:
![]()
Equação geral de uma reação de simples troca
Observando o esquema da equação geral de uma reação de simples troca, podemos concluir que nela sempre teremos um mesmo padrão de substâncias nos reagentes e produtos:
-
Reagentes: uma substância simples (X) e uma substância composta (YZ);
-
Produtos: uma substância composta (XZ) e uma substância simples (Y).
Neste texto, vamos falar sobre as reações de simples troca com metais. Com base no esquema acima, os metais seriam X e Y. Em uma reação desse tipo, o metal da substância composta é deslocado (trocado) pelo metal da substância simples.
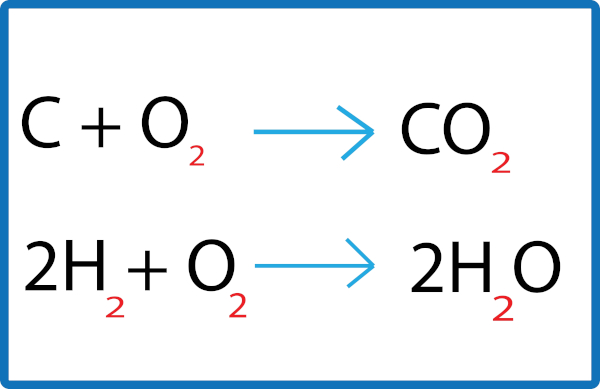
O resultado de uma reação de simples troca entre metais é sempre a formação de uma nova substância composta que possui o metal que estava na forma de substância simples e uma substância simples com o metal que fazia parte da substância composta. Na equação a seguir, podemos observar como ocorre esse processo:
Trocas ocorrendo em uma reação de simples troca
Observação: Um metal X somente consegue deslocar um metal Y presente em uma substância composta se ele for o mais reativo. Para saber se um metal é mais reativo que outro, basta conhecer a ordem decrescente de reatividade dos metais:
Li>Rb>K>Cs>Ba>Sr>Ca>Na>Mg>Al>Zn>Cr>Fe+2>Cd>Co>Ni>Sn>Pb>Fe+3>H+>Cu>Hg2+2>Ag> Pd>Hg+2>Pt>Au
Veja alguns exemplos de reações de simples troca com metais:
-
Reação entre o Mg e o FeCl3
3 Mg + 2 FeCl3 → 3 MgCl2 + 2 Fe
Analisando a ordem decrescente de reatividade, o Mg é mais reativo que o elemento Fe presente na substância composta, o que causará o deslocamento do Fe provocado pelo Mg. Como o Mg apresenta carga +2 na forma de cátion, ao se unir com o Cl, que tem carga -1, a fórmula da substância será MgCl2.
-
Reação entre o Al e o HCl
2 Al + 6 HCl → 2 AlCl3 + 3 H2
Analisando a ordem decrescente de reatividade, o Al é mais reativo que o elemento H presente na substância composta, o que causará o deslocamento do H provocado pelo Al. Como o Al apresenta carga +3 na forma de cátion, ao se unir com o Cl, que tem carga -1, a fórmula da substância será AlCl3. O H tem índice 2 na sua fórmula porque não é um metal e forma, assim como quase todos os ametais, compostos simples com dois átomos.
-
Reação entre o Au e o CaBr2
Au + CaBr2 → não ocorre a reação
Analisando a ordem decrescente de reatividade, podemos observar que o Au é menos reativo que o elemento Ca presente na substância composta, logo, não haverá o deslocamento do Ca provocado pelo Au.
-
Reação entre o Cr e o PbSO4
2 Cr + 3 PbSO4 → Cr2(SO4)3 + 3 Pb
Analisando a ordem decrescente de reatividade, podemos observar que o Cr é mais reativo que o elemento Pb presente na substância composta, o que causará o deslocamento do Pb provocado pelo Cr. Como o Cr apresenta carga +3 na forma de cátion, ao se unir com o SO4, que tem carga -2, a fórmula da substância será Cr2(SO4)3.
-
Reação entre o Hg e o HNO3
Hg + HNO3 → não ocorre a reação
Analisando a ordem decrescente de reatividade, podemos observar que o Hg é menos reativo que o elemento H presente na substância composta, logo, não haverá o deslocamento do H provocado pelo Hg.
-
Reação entre o Ni e o AgBrO2
Ni + 2 AgBrO2 → Ni(BrO2)2 + 2 Ag
Analisando a ordem decrescente de reatividade, podemos observar que o Ni é mais reativo que o elemento Ag presente na substância composta, logo, haverá o deslocamento do Ag provocado pelo Ni. Como o Ni apresenta carga +2 na forma de cátion, ao se unir com o BrO2, que tem carga -1, a fórmula da substância será Ni(BrO2)2.
Por Me. Diogo Lopes Dias
Videoaula relacionada: