Ácido Acético
O ácido acético ou etanoico é o principal componente do vinagre, sendo responsável por seu sabor azedo. Sua principal obtenção é pela oxidação do etanol do vinho.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
O ácido acético ou ácido etanoico (nomenclatura oficial) é o ácido carboxílico mais comum e importante no cotidiano, cuja fórmula é CH3COOH. A estrutura do ácido acético é mostrada a seguir:
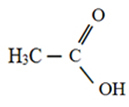
Estrutura do ácido etanoico ou acético
Em condições ambientes, esse composto é líquido, pois seu ponto de fusão é igual a 16,6 ºC e seu ponto de ebulição é igual a 118 ºC. Além disso, possui sabor azedo, cheiro forte e irritante, é reativo e solúvel em água, éter e álcool.
A sua primeira forma de obtenção foi a partir da oxidação do álcool (etanol) do vinho, que forma o vinagre. Portanto, o vinagre nada mais é que uma solução aquosa com cerca de 6 a 10% de ácido acético em massa. É esse ácido que confere sabor azedo ao vinagre, vindo daí o seu nome, pois, em latim, acetum significa “azedo”.
Não se sabe ao certo, mas se acredita que o ácido etanoico tenha sido obtido pela primeira vez pelo alquimista persa Jabir Hayyan (Geber), através de uma destilação, por volta de 700 d.C. Esse ácido foi sintetizado em 1845 por um processo de destilação industrial criado pelo químico alemão Adolf Hermann Kolbe (1818-1884).
O ácido acético ou o vinagre é obtido de forma natural pela oxidação do álcool etílico, um processo aeróbico (ocorre somente na presença de oxigênio do ar) realizado na presença de bactérias do gênero Acetobacter. No caso do vinho, da cidra, do malte ou do próprio álcool diluído, a fermentação ocorre por meio da ação do fungo Micoderma aceti, com a participação da enzima alcooloxidase. Essa reação em escala industrial pode fazer uso de catalisadores que aceleram o processo, além de temperaturas e pressões elevadas:
CH3 — CH2 — OH + O2 → CH3 — COOH + H2O
etanol ar ácido acético água
Outras formas de obtenção são por meio da carbonilação do metanol e a partir de derivados do petróleo, como o butano:
* CH3 — OH + CO → CH3 — COOH
metanol ácido acético
* C4H10 + [O] → CH3 — COOH + CO + CO2 + 3 H2O
butano ácido acético
O ácido acético é conhecido desde a Antiguidade. Os soldados romanos no século III a.C. levavam um frasco contendo um vinho azedo diluído, o ácido acético, porque precisavam marchar por longas distâncias. Pequenos goles desse líquido estimulavam a salivação e diminuíam a sensação de sede.

As legiões de soldados romanos que conquistaram grande parte do mundo no século III a.C. levavam vinagre consigo*
Além do vinagre usado principalmente como tempero de saladas, o ácido acético também é usado para a produção de polímeros, como o PVA (Poliacetato de Vinila), essências artificiais para a perfumaria, tintas, corantes, sedas sintéticas, como o acetato de celulose, medicamentos, como o ácido acetilsalicílico (AAS – aspirina®), em solventes, na produção de anidrido acético e de cloreto de acetila, além de acetatos orgânicos.
Nessas aplicações industriais, ele é comercializado como ácido acético glacial (pureza de aproximadamente 99,5%), que recebe esse nome porque, em temperaturas menores que 16,7ºC, solidifica-se e fica com um aspecto parecido com o do gelo, conforme as imagens a seguir:
.jpg)
O ácido acético glacial tem o aspecto de cristais semelhante ao gelo
__________________
* Créditos da imagem: meunierd/Shutterstock.com.
Por Jennifer Fogaça
Graduada em Química



