Alcenos
Os alcenos ou alquenos são hidrocarbonetos de cadeia aberta que possuem uma ligação dupla entre dois carbonos de sua cadeia.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Os alcenos são hidrocarbonetos acíclicos e insaturados, ou seja, são compostos orgânicos cujas moléculas são formadas apenas por átomos de hidrogênio e carbono, de cadeia aberta e que possuem uma dupla ligação entre dois de seus carbonos.
Esses compostos são mais reativos que os alcanos, pois a ligação pi (da dupla ligação) é mais fácil de ser rompida, realizando principalmente reações de adição. Uma dessas reações é a hidratação do eteno, que produz o etanol, sendo muito usada em países em que o cultivo da cana-de-açúcar ou do milho não é economicamente viável:
.jpg)
Os alcenos são também chamados de alquenos, hidrocarbonetos etilênicos (porque o menor alceno é o eteno, ou etileno, e todos os outros derivam dele) e de olefinas (porque todos os alcenos de cinco carbonos ou mais são substâncias oleosas).
A nomenclatura desses compostos segue a mesma regra estabelecida para os alcanos, com a única diferença de que, visto que possui uma ligação dupla, ela deve ser indicada pelo infixo “en", no lugar do “an" usado nos alcanos.

Nomenclatura dos alcenos não ramificados
Exemplos:
H2C = CH2: et + en + o → eteno
H2C = CH — CH3: prop + en + o → propeno
Além disso, se o alceno tiver quatro ou mais átomos de carbono, a cadeia principal deve ser numerada (a que contém a dupla ligação e que possui maior quantidade de átomos de carbono) e deve haver a indicação do número do carbono de onde a dupla ligação está saindo. Isso é feito colocando-se o número menor antes do infixo “en". Lembre-se de que a numeração da cadeia deve começar o mais perto possível da dupla ligação.
H2C = CH — CH2 — CH3: but-1-eno
H3C — CH = CH — CH3: but-2-eno
H3C — CH2 — CH2 — CH = CH — CH3: hex-2-eno
Se o alceno for ramificado, a ramificação deve ser indicada antes do nome da cadeia principal, indicando de qual carbono a ramificação está saindo:
6 5 4 3 2 1
H3C — CH — CH2 — CH = CH — CH3: 5-metil-hex-2-eno
|
CH3
3 4 5 6 7
H3C — CH2 — CH2 — CH2 — CH2 — CH2 — CH2 — CH3: 3-propil-hept-1-eno
|
2CH
||
1CH2
Todos os alcenos seguem a seguinte fórmula geral: CnH2n, sendo que “n” é um número inteiro e positivo igual a 2 ou maior. Veja os exemplos abaixo:
H2C = CH2: (n = 2) → C2H4
H2C = CH — CH3: (n = 3) → C3H6
H2C = CH — CH2 — CH3: (n = 4) → C4H8
H3C — CH2 — CH2 — CH = CH — CH3: (n = 6) → C6H12
Os alcenos raramente ocorrem na natureza, sendo geralmente obtidos pelo craqueamento de alcanos de cadeia longa provenientes do refino do petróleo, ou seja, esses alcanos passam por uma cisão térmica em que uma molécula é quebrada em dois ou mais fragmentos, como mostra o exemplo abaixo:
1 C12H26(![]() ) → 1 C8H18(
) → 1 C8H18(![]() ) + 1 C2H4(g)
) + 1 C2H4(g)
dodecano octano eteno
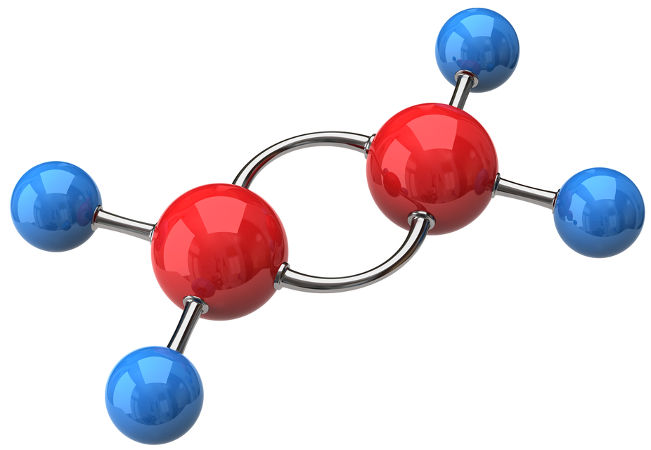
O eteno ou etileno é o principal alceno usado industrialmente, ocupando a quinta posição de todos os compostos usados, ficando atrás somente do ácido sulfúrico, óxido de cálcio, amônia e oxigênio.
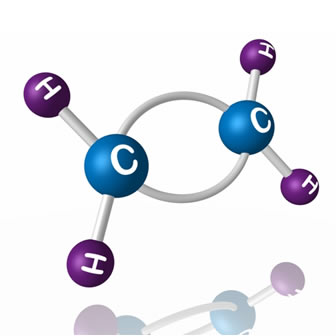
Molécula de eteno ou etileno
Na natureza, ele é produzido por diversas frutas, sendo o responsável por seu amadurecimento. É por isso que se pegarmos um cacho de bananas verdes e colocarmos em um recipiente fechado ou cobri-lo com um jornal, como se “aprisionássemos” o gás eteno, as bananas amadurecerão mais rápido.
Outra aplicação importante desse alceno é que ele dá origem a um polímero muito usado em nosso cotidiano, o polietileno:
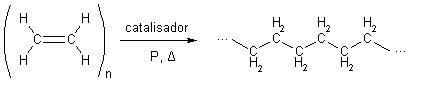
Polimerização do eteno em polietileno
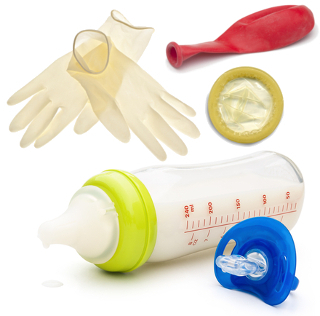
Esse polímero é muito usado porque, além de ser de baixo custo, ele tem alta resistência à umidade, ao ataque de substâncias químicas, como solventes em geral, e também é versátil, pois se o polímero formado for de cadeia reta, temos um polímero de alta densidade (PEAD ou HDPE), que é mais rígido e usado na produção de garrafas, brinquedos e outros objetos.
Por outro lado, o polietileno de cadeia ramificada é de baixa densidade (PEBD ou LDPE), sendo usado na produção de sacolas, revestimentos de fios, cabos, tubos, embalagens de produtos farmacêuticos, películas plásticas e folhas de embalagens de alimentos.

Materiais feitos de polietileno de baixa densidade
Aproveite para conferir nossa videoaula relacionada ao assunto: