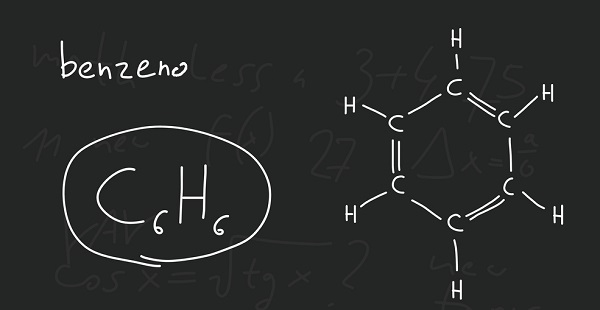
Benzeno
O benzeno é a base para hidrocarbonetos aromáticos, composto tóxico, utilizado como reagente para obtenção de outras substâncias químicas.
Por Laysa Bernardes Marques de Araújo
PUBLICIDADE
O benzeno é um hidrocarboneto base para compostos orgânicos aromáticos. Ele foi descoberto por August Kekulé, que, inspirado por um sonho, descreveu, em 1866, a estrutura que conhecemos hoje. É utilizado em combustíveis automotivos, para aumentar a potência dos motores, e como reagente para obtenção de outras substâncias químicas.
O uso do benzeno é controlado, pois trata-se de um agente tóxico, causador de problemas, como enjoos, irritações na pele e até câncer. A nomenclatura para hidrocarbonetos aromáticos, ou seja, que contenham pelo menos um benzeno é dada por localização do radical (quando houver mais de um) + nome do radical + benzeno.
Leia também: Quais são as classificações das cadeias carbônicas?
Características e propriedades do benzeno

-
Hidrocarboneto fechado, insaturado.
-
Possui seis carbonos realizando ligações simples e duplas de forma alternada.
-
A estrutura de um benzeno tem forma de um hexágono.
-
Ponto de fusão: 5,5°C.
-
Ponto de ebulição 80,1°C.
-
Composto altamente volátil (tendência a entrar no estado gasoso).
-
Massa molar: 78,11 g/mol.
-
Densidade: 0,88 g/cm³ (menor que a densidade da água).
-
Benzeno é um composto apolar devido à distribuição uniforme das cargas, proporcionada pela ressonância da molécula.
-
Solúvel em solventes orgânicos.
-
Quimicamente falando, o benzeno é um composto estável, apesar das insaturações na molécula, isso se deve à ressonância das ligações. É mais propenso a realizar reações de substituição do que de adição.
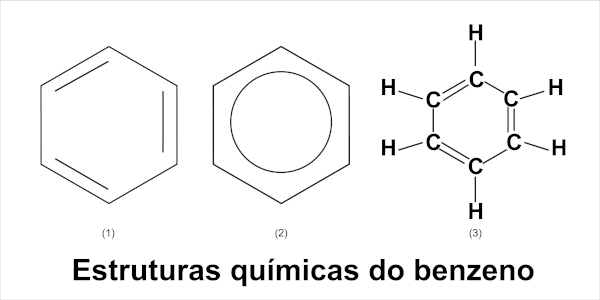
Fórmula do benzeno
A fórmula estrutural do benzeno é de um hexágono que apresenta em cada vértice um carbono ligado a um hidrogênio, o que resulta na fórmula molecular C6H6. As ligações entre os carbonos alternam-se entre simples e dupla. Para esse composto, existem três diferentes formas de representação estrutural, veja a imagem a seguir:
Nomenclatura de compostos com benzeno
A nomenclatura para compostos que possuem benzeno segue as regras estabelecidas pela União Internacional de Química Pura e Aplicada (IUPAC) para os hidrocarbonetos. O nome do composto será composto por:
Nome do radical + benzeno
Quando for mais de um radical, deve-se indicar a localização dos radicais e deve ser utilizada ordem alfabética.
→ Nome dos radicais substituintes
A nomenclatura para radicais é formada pelo prefixo indicativo da quantidade de carbonos e pela terminação -il ou -ila.
Prefixos:
-
Met – 1 carbono
-
Et – 2 carbonos
-
Prop – 3 carbonos
-
But – 4 carbonos
-
Pent – 5 carbonos
→ Localização dos radicais
A localização deve ser indicada pelo número do carbono em que ocorre a substituição. Só é necessário deixar explícito a posição quando tiver mais de um radical.
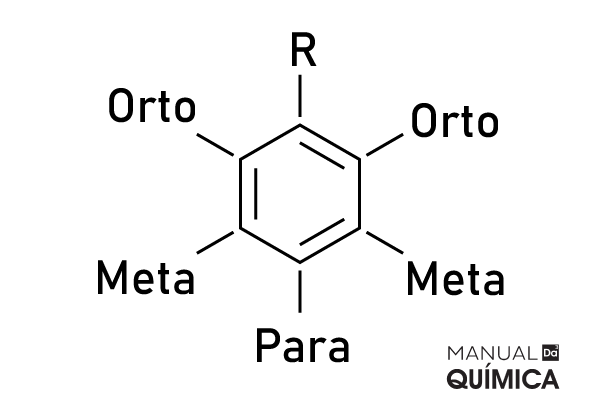
Para benzenos com duas substituições, teremos nomes específicos para o posicionamento que podem ser usados no lugar dos numerais:
-
Substituições nos carbonos 1,2: orto
-
Substituições nos carbonos 1,3: meta
-
Substituições nos carbonos 1,4: para
Exemplos
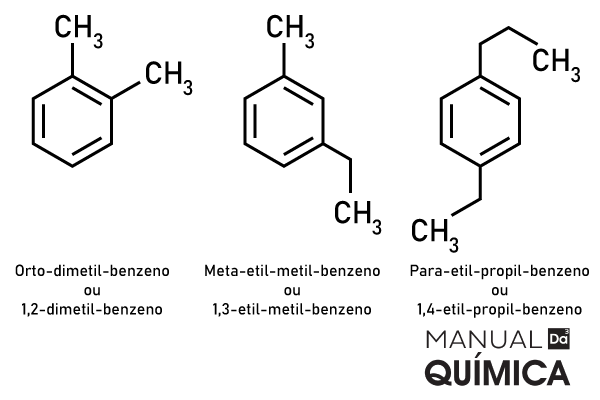
Veja também: Nomenclatura das cadeias ramificadas – constituintes e regras
Onde o benzeno é encontrado?
O benzeno pode ser encontrado em alguns processos naturais, como em:
-
atividades vulcânicas,
-
queimadas florestais,
-
no alcatrão de hulha (a madeira fossilizada e transformada em carvão).
E também em atividades antrópicas, como em:
-
subproduto do refino do petróleo,
-
queima de cigarros,
-
principal produto da reação de combustão do policloreto de vinila, conhecido como PVC (um dos plásticos mais produzidos no mundo).

Para que serve o benzeno?
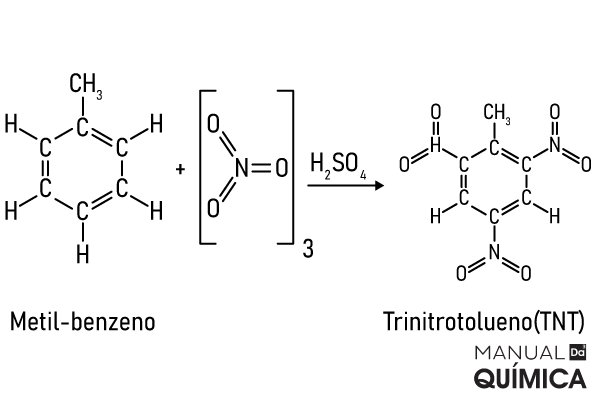
A maior utilização industrial do benzeno é como reagente para obter-se outras substâncias químicas, como o hidrocarboneto aromático tolueno, também conhecido como metilbenzeno ou ainda toluol, que é aplicado na produção de trinitrotolueno (TNT) que, por sua vez, é usado para fabricação de explosivos, tintas e materiais fotográficos.
A seguir, está apresentada a reação de substituição que acontece com o metilbenzeno para que se torne o trinitrotolueno. Esta reação é feita utilizando ácido sulfúrico (H2SO4) como catalisador:
Benzenos com duas substituições de CH4, ou seja, dois radicais metil, são chamados xilenos, sendo três tipos de xileno devido às diferentes posições para os radicais, veja a imagem a seguir:
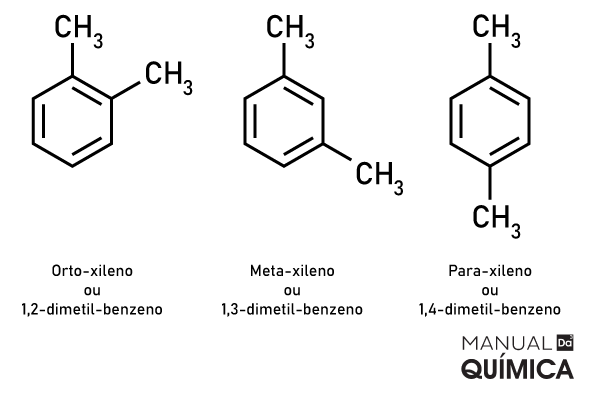
Os xilenos são utilizados comercialmente em indústrias de tintas, vernizes e pigmentos têxteis, possuem maior tempo de secagem que o metilbenzeno, são também excelentes solventes de resinas, com menor potencial volátil.
Além disso, o benzeno é aplicado a combustíveis automotivos para aumentar a octanagem, otimizando, assim, o desempenho do motor.
Acesse também: Propriedades dos compostos orgânicos: quais são?
Intoxicação pelo benzeno
O benzeno é uma substância de alto potencial tóxico. No Brasil, o teor máximo de benzeno permitido em produtos finais é 0,1%, e a concentração máxima de benzeno aplicado em combustível automotivo é de 10ml para cada litro. Por ser um composto muito volátil, a principal forma de intoxicação do benzeno é por inalação.
A exposição a curto prazo pode causar náuseas, estomatites, taquicardia, tontura, vertigens e sonolência. Já a exposição a longo prazo pode causar alterações genéticas e cancro, que é o crescimento desordenado de células que se desenvolve em tumores malignos.
O manuseio inadequado do benzeno, sem auxílio de equipamento de proteção individual (EPI) é um risco, pois, quando em contato com a pele e olhos, causa irritação e ardência e se for ingerido pode causar danos aos pulmões.
Estudos mostram que trabalhadores que têm contato frequente com o benzeno estão propensos a desenvolver leucemia mieloide aguda, que é um tipo de câncer. A Agência Internacional de Pesquisa em Câncer (IARC) classificou o benzeno como agente cancerígeno humano, do grupo 1.

Curiosidades sobre o benzeno
-
A estrutura final do benzeno foi dada por August Kekule em 1866 após um sonho, em que serpentes giravam mordendo a própria calda, o cientista associou o sonho aos seus estudos, e chegou à conclusão de que se tratava de um composto, cíclico e aromático.
-
No século IX, o benzeno era utilizado na fabricação de loção pós-barba devido ao aroma agradável que a substância agregava ao produto.
- Em 1970, mortes causadas por leucemia foram associadas ao benzeno que era utilizado na fabricação de um material chamado pliofilm utilizado em capas de chuva.
Leia também: Da alquimia à química – trajetória de consolidação dessa ciência
Exercícios resolvidos
Questão 1 – (UFOP -MG - adaptada) Considere a série de compostos aromáticos indicados de I a VI.
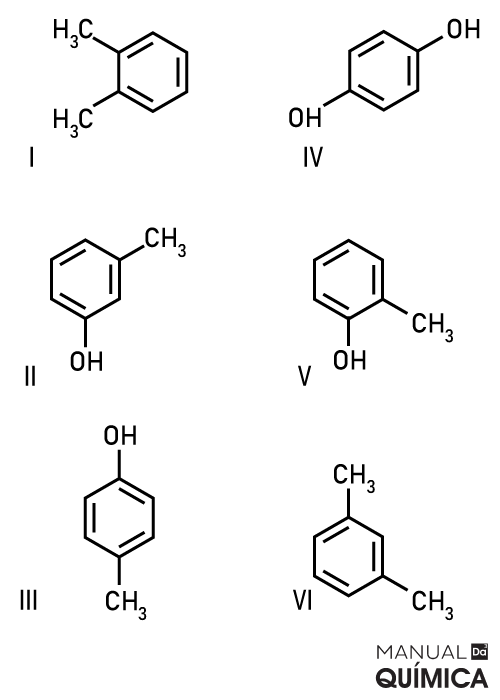
São nomeadas, utilizando o prefixo meta e para, respectivamente, as substâncias do par:
A) I e IV.
B) II e IV.
C) III e V.
D) VI e II.
E) I e II
Resolução
Alternativa B. Os compostos com substituições na posição meta, carbonos 1 e 3, e para, com radicais nos carbonos 1 e 4, são os compostos II e IV. As outras alternativas apresentam compostos com posicionamentos diferentes.
Questão 2 – (UFPI – 2010) A aromaticidade é uma importante propriedade relacionada com a estabilidade dos compostos orgânicos. Os compostos aromáticos apresentam algumas características estruturais que lhes conferem estabilidade. Observe as estruturas dos compostos adiante.
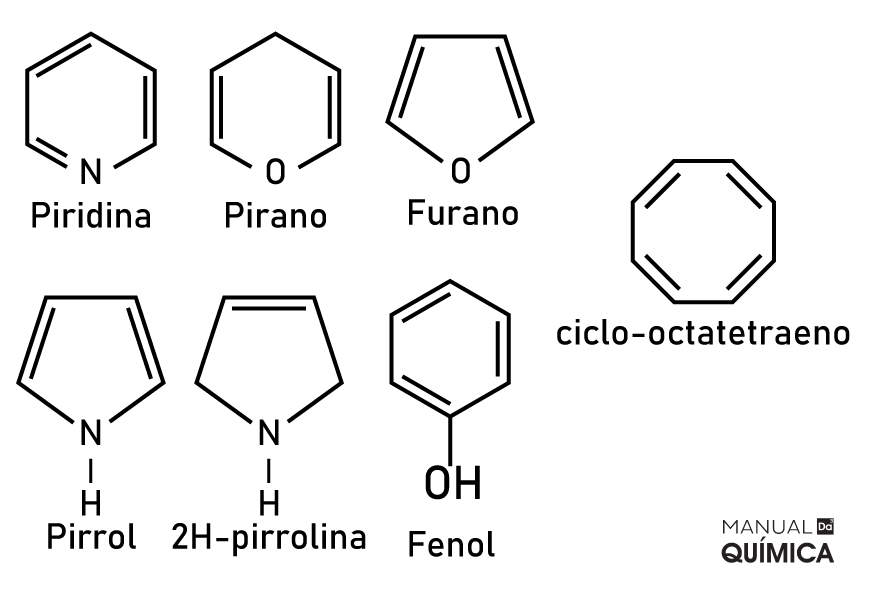
Pode-se concluir que:
A) todos são aromáticos.
B) apenas fenol, pirano e piridina são aromáticos.
C) apenas furano, piridina e pirrol são aromáticos.
D) apenas furano, pirano, piridina e pirrol são aromáticos.
E) apenas fenol, furano, pirrol e piridina são aromáticos.
Resolução
Alternativa E. A característica aromática não pertence apenas aos benzenos, a aromaticidade ocorre pelo transitar dos elétrons entre uma ligação e outra. Compostos cíclicos planares com ligações simples e duplas alternadas são aromáticos, o ciclo-octatetraeno não é aromático por não ser uma molécula planar. Já o furano e o pirrol, apesar de não terem todas as ligações alternando entre dupla e simples, têm um elemento com um par eletrônico que interage com as insaturações do composto, gerando movimentação dos elétrons e, assim, aromaticidade na molécula.