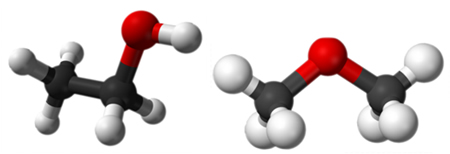
Carbono quiral
Carbono quiral é um carbono sp3 que apresenta quatro ligantes diferentes. Os carbonos quirais dão origem aos isômeros ópticos (enantiômeros).
Por Stéfano Araújo Novais
PUBLICIDADE
Carbono quiral é um carbono de hibridização sp3 (arranjo tetraédrico) que está ligado a quatro grupos completamente diferentes. Também é possível chamar os carbonos quirais de assimétricos. Alguns autores, embora não haja ordenação oficial, indicam carbonos quirais por meio de asteriscos (*).
Os carbonos quirais podem ser identificados na estrutura com base numa avaliação simples da fórmula estrutural, assim, basta perceber se o carbono atende aos critérios de elegibilidade para quiralidade. Os carbonos quirais dão origem aos enantiômeros, isômeros ópticos que apresentam relação de objeto-imagem, ou seja, moléculas não sobreponíveis.
Leia também: Carbono — propriedades, ligações, ciclo, aplicações e muito mais
Resumo sobre carbono quiral
- Carbono quiral (ou assimétrico) é um carbono de hibridização sp3 (geometria tetraédrica) que se liga a quatro grupos completamente diferentes.
- O termo quiral vem do grego e significa “mão”.
- Um carbono quiral pode ocorrer tanto em cadeias abertas quanto em fechadas.
- Alguns autores marcam o carbono quiral por meio de um asterisco (*), embora não exista uma regra específica para tal.
- Pode-se identificar um carbono quiral por meio de uma análise da sua fórmula estrutural.
- Os carbonos quirais dão origem aos isômeros ópticos (enantiômeros).
O que é carbono quiral?
Em Química orgânica, diz-se que um carbono é quiral é o carbono que apresenta hibridização sp3 (geometria tetraédrica) e está ligado a quatro grupos completamente diferentes. É comumente utilizado o sinônimo assimétrico para o nome quiral.
Representação do carbono quiral
A representação de um carbono quiral é igual à dos demais carbonos da cadeia, não havendo uma regra específica para sua representação. Contudo, alguns autores optam por utilizar um asterisco (*) para destacar o carbono quiral na estrutura.
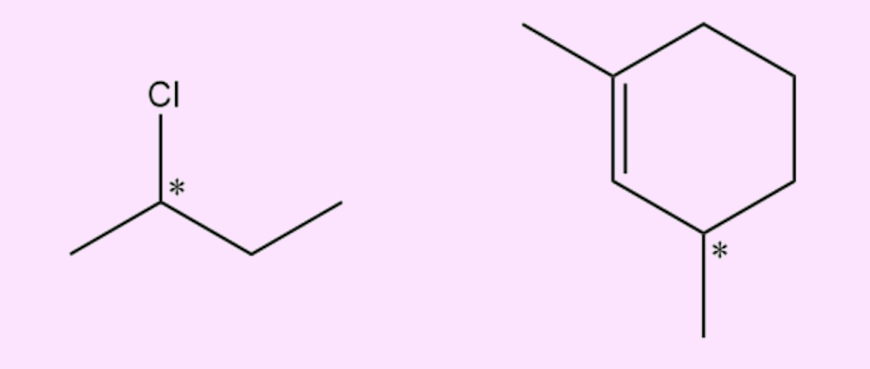
Como identificar o carbono quiral?
A presença de carbonos quirais pode ser feita pela análise da fórmula estrutural do composto. Basta perceber se os grupos ligados ao carbono analisado são diferentes ou não.
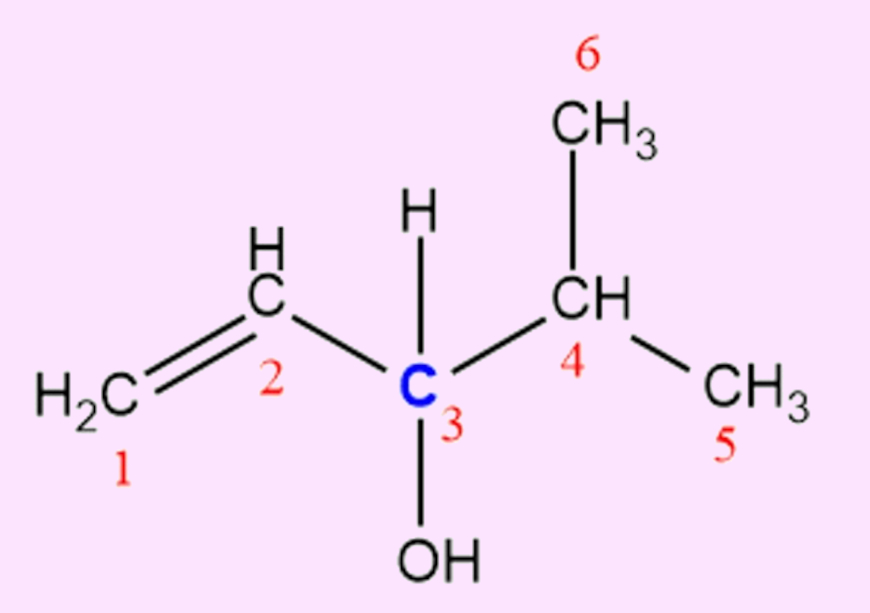
Perceba no exemplo anterior que apenas o carbono assinalado com o número 3 é sp3 e está ligado a quatro grupos completamente diferentes: um radical hidroxila (OH), um átomo de hidrogênio (H) e duas cadeias carbônicas distintas entre si. Os carbonos 1 e 2 são sp2, não podendo ser quirais. O carbono 4 apresenta dois ligantes iguais, os carbonos 5 e 6 (radicais metil, −CH3). Já os carbonos 5 e 6 estão ligados a três átomos de hidrogênio, o que os impedem de ser quirais.
Em compostos cíclicos, a quiralidade pode ser percebida passando-se uma linha reta pelo carbono em análise. Caso um lado do ciclo seja diferente do outro, então o carbono é quiral. Veja no exemplo a seguir.
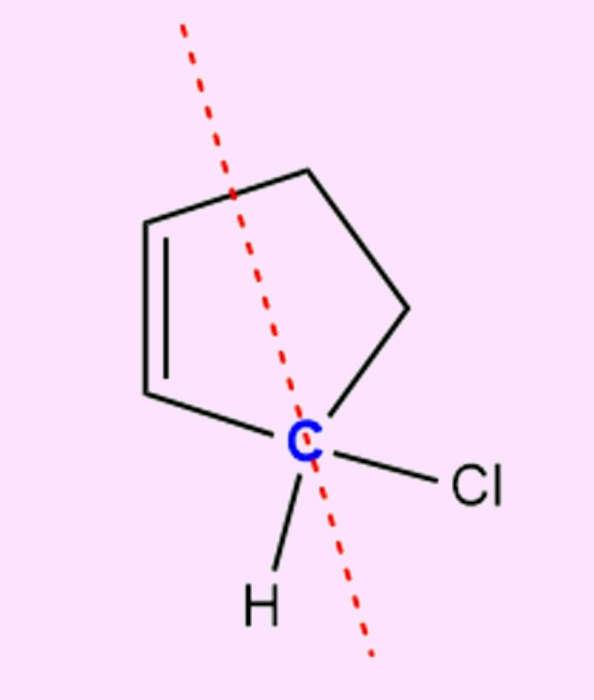
Perceba que o carbono analisado (em azul), além de ser sp3 e ter ligantes diferentes (H e Cl), tem um lado do ciclo diferente do outro. Outra forma de perceber se o carbono de um ciclo é quiral é vendo a cadeia construída no sentido horário e anti-horário. Se elas forem diferentes, então o carbono é quiral.
Vejamos no exemplo anterior, por exemplo. Além de hidrogênio e cloro, se tomarmos o caminho horário do carbono analisado (azul), a cadeia construída será: −CH=CH−CH2−CH2−. Já no sentido anti-horário, a cadeia construída será: −CH2−CH2−CH=CH−. Assim, como as cadeias analisadas no sentido horário e anti-horário são iguais, então o carbono analisado é quiral.
Veja também: O que é isomeria?
Importância do carbono quiral
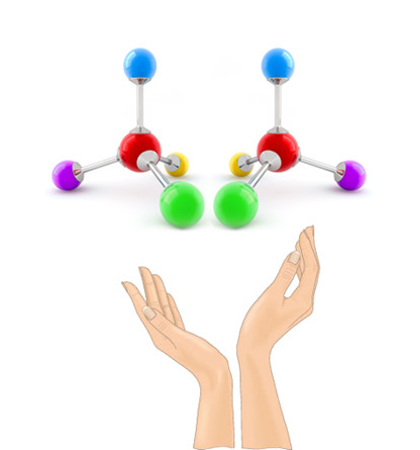
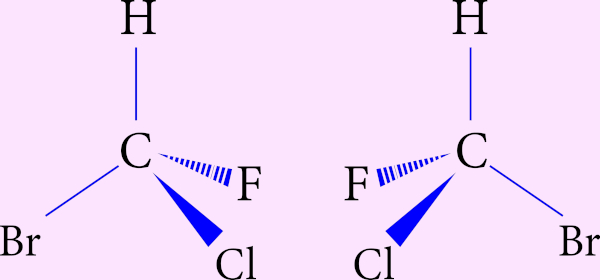
Cada carbono quiral presente em uma molécula dá origem a um par de isômeros ópticos, conhecidos como enantiômeros. Esses isômeros têm uma relação de objeto-imagem, ou seja, não são sobreponíveis. Inclusive, a palavra quiral vem do grego, kheir, que significa “mão”, uma vez que a mão direita e a mão esquerda não são sobreponíveis. Na imagem abaixo, os enantiômeros estão separados por um espelho plano imaginário, demonstrando a relação objeto-imagem.
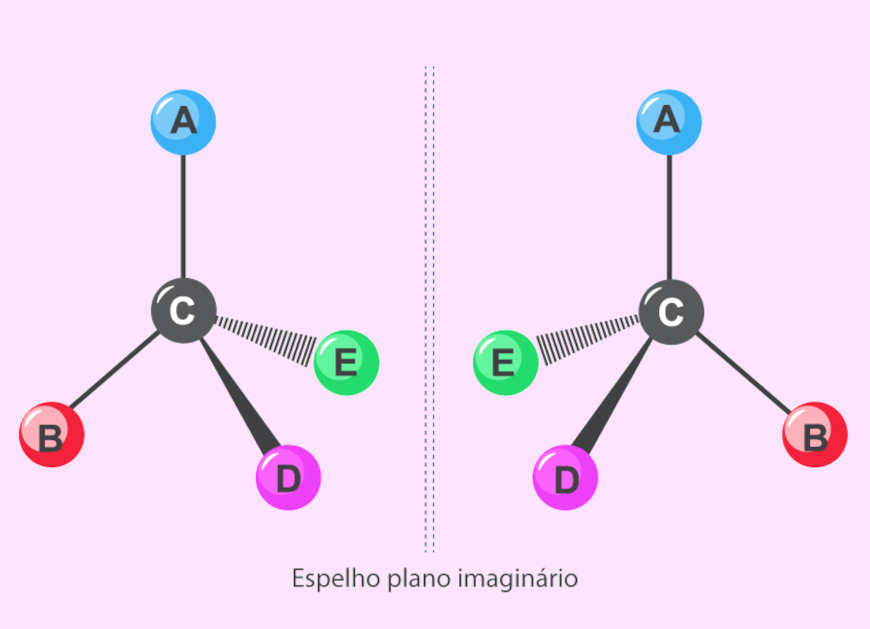
Os enantiômeros são praticamente idênticos em propriedades físicas, como temperaturas de fusão e ebulição, densidade etc., mas diferem quanto à sua relação com o plano da luz polarizada: enquanto um enantiômero desvia a luz polarizada para a direita, o outro a desvia para a esquerda, sendo essa uma das principais formas de distingui-los.
Contudo, quimica e biologicamente, os enantiômeros podem se comportar diferentemente. Isso é muito importante, por exemplo, no desenvolvimento de fármacos. Havendo a formação de enantiômeros, é preciso avaliar se um dos enantiômeros será nocivo à saúde do paciente. E, mesmo que o isômero seja inócuo, ele acaba por interferir no balanço de massa e no rendimento reacional, necessitando de cálculos para ajuste.
O número de isômeros ópticos ativos gerados por carbonos quirais nas moléculas pode ser previsto pela regra de Van’t Hoff:
I.O.A = 2n em que n = n° carbonos quirais
Carbono quiral x carbono assimétrico
Quiral e assimétrico são sinônimos para o carbono, assim sendo, é possível utilizar as duas designações normalmente. A Iupac até busca, por meio da utilização de termos, fazer certa diferenciação ao dizer que um carbono quiral é um átomo de carbono que tem um arranjo espacial de ligantes que não é sobreponível à sua imagem. No entanto, isso só é possível ocorrer se o carbono for assimétrico, por isso, os termos são sinônimos.
Saiba mais: Como são classificadas as cadeias carbônicas
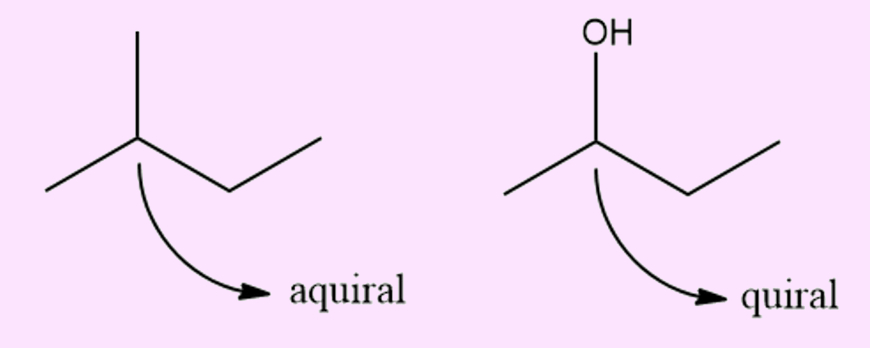
Diferenças entre quiral e aquiral
O prefixo “a−” significa negação, assim sendo, um carbono aquiral é um carbono que não é quiral, ou seja, que tem, ao menos, dois ligantes iguais e/ou que não apresenta arranjo tetraédrico (hibridização sp3).
Exercícios resolvidos sobre carbono quiral
Questão 1. (USS-Univassouras/2020) A valina é um aminoácido essencial que participa do processo de crescimento muscular. Observe abaixo a fórmula estrutural plana de um dos isômeros ópticos desse aminoácido, na qual os algarismos de I a IV sinalizam os átomos de carbono da cadeia:
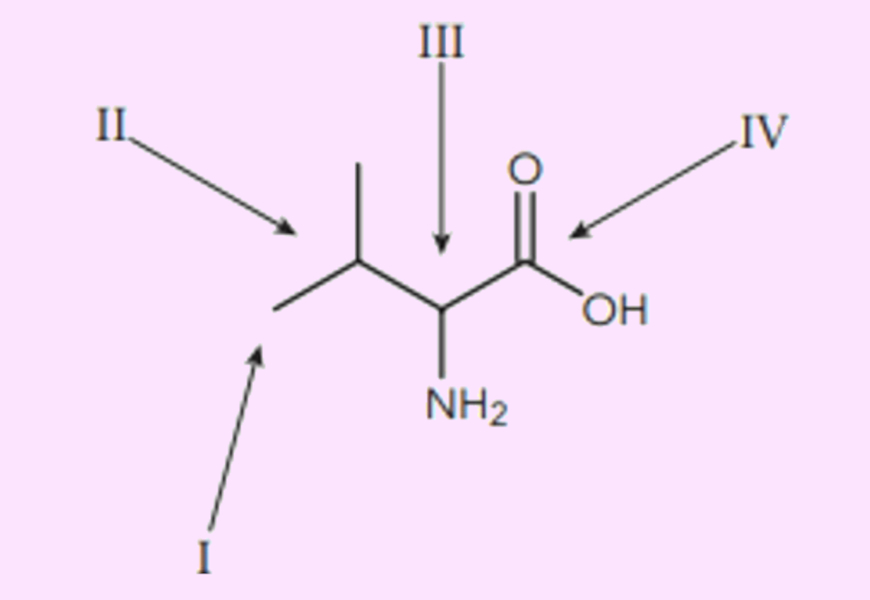
O átomo de carbono responsável pela quiralidade dessa molécula é:
- I
- II
- III
- IV
Resposta: Letra C
O átomo III está ligado a quatro ligantes diferentes: um átomo de hidrogênio (não representado na fórmula bastão), um grupo amino (−NH2), uma carboxila (−COOH) e um radical isopropil.
O carbono I não é quiral, pois está ligado a três átomos de hidrogênios; o II não é quiral, pois está ligado a duas cadeias idênticas (−CH3). Já o carbono IV não é sp3.
Questão 2. (Albert Einstein/2019) Examine a estrutura do glutamato monossódico, composto utilizado para realçar o sabor de alimentos.
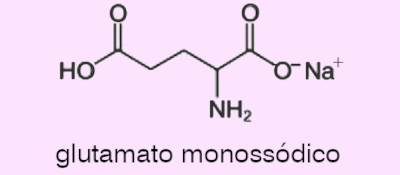
O número de átomos de carbono quiral presente na estrutura do glutamato monossódico é
a) 3.
b) 2.
c) 4.
d) 5.
e) 1.
Resposta: Letra E
O único carbono quiral/assimétrico é o que está ligado ao radical amina (−NH2). Os demais ou estão ligados a 2 átomos de hidrogênio (são –CH2−) ou não são sp3 (na carbonila o carbono tem hibridização sp2).
Fontes
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. GoldBook – Compendium of Chemical Terminology. Disponível em: https://goldbook.iupac.org/
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.