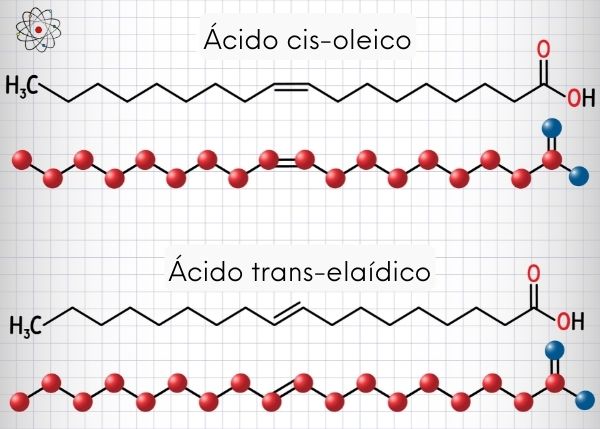
Isomeria geométrica E-Z
A isomeria E-Z é um tipo de estereoisomeria que se baseia na diferença dos números atômicos dos ligantes em uma cadeia.
Por Diogo Lopes Dias
PUBLICIDADE
Na isomeria geométrica E-Z, que é um tipo específico de estereoisomeria, comparamos a organização espacial dos átomos de duas moléculas de uma mesma substância. Ela é utilizada sempre que os termos geométricos cis-trans tornam-se insuficientes para definir a isomeria geométrica das estruturas. Para realizar essa análise, obrigatoriamente as cadeias estudadas devem apresentar as seguintes características:
-
cadeias abertas com uma ligação dupla entre os carbonos;
-
cadeias fechadas;
-
A cadeia deve apresentar dois carbonos com pelo menos três ligantes diferentes entre si (na dupla ligação ou em qualquer local da cadeia fechada).
Observação: Quando os ligantes de um dos carbonos da dupla são iguais aos ligantes do outro carbono da dupla, a isomeria é cis-trans.
O exemplo geral abaixo apresenta um caso de isomeria E-Z, já que todos os ligantes dos carbonos da dupla são diferentes entre si.
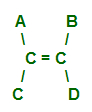
Na estrutura, temos dois carbonos com ligantes diferentes entre si
Os critérios acima são utilizados para o estudo da isomeria geométrica E-Z levando-se em consideração o posicionamento dos ligantes dos carbonos avaliados, já que, como na cadeia fechada ou naquela com a presença da ligação dupla não existe o fenômeno da rotação, é possível dividi-la em um plano superior e outro inferior. No esquema a seguir, temos a representação do plano que separa a estrutura em plano (sempre corta os dois carbonos com ligantes diferentes) inferior e superior.
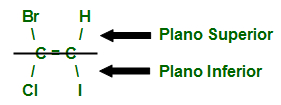
Plano delimitando ligantes da região inferior e superior da molécula
Como na isomeria E-Z todos os quatro ligantes avaliados são diferentes entre si, levamos em consideração a diferença do número atômico desses ligantes. Quando temos o ligante de cada um dos carbonos da dupla de maior número atômico no mesmo plano, trata-se de um isômero Z, já que Z (ZusammenEntgegen) significa “juntos” em alemão. Se os ligantes de maior número atômico de ambos os carbonos da dupla estiverem em planos diferentes, teremos um isômero E, já que E (Entgegen) significa opostos em alemão.
Acompanhe cinco exemplos de determinação da isomeria E-Z:
1º) 2-Bromo-1-cloro-1-flúor-eteno
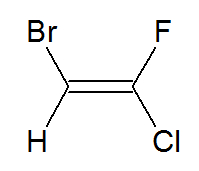
Na estrutura, temos os elementos bromo (Z=35) e hidrogênio (Z=1) em um dos carbonos da dupla, e o flúor (Z=9) e o cloro (Z=17) no outro carbono. Como o plano passa entre os carbonos da dupla, o bromo, que é o ligante com maior número atômico do carbono, fica à esquerda no plano superior, e o cloro, que é o ligante com maior número atômico do carbono, fica à direita no plano inferior. Como os ligantes de maior número atômico estão em planos diferentes, trata-se de um isômero geométrico E.
2º) 1-cloro-1flúor-propeno
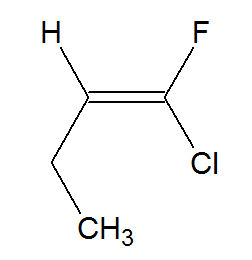
Na estrutura, temos um etil (considera-se o carbono ligado ao carbono da dupla, Z=6) e o hidrogênio (Z=1) em um dos carbonos da dupla, e o flúor (Z=9) e o cloro (Z=17) no outro carbono. Como o plano passa entre os carbonos da dupla, o etil, que é o ligante com maior número atômico do carbono, fica à esquerda no plano inferior, e o cloro, que é o ligante com maior número atômico do carbono, à direita no plano inferior. Como os ligantes de maior número atômico estão no mesmo plano, trata-se de um isômero geométrico Z.
Observação: Quando tivermos no mesmo carbono como ligantes um radical e um hidrogênio, sempre consideraremos o número atômico do carbono para o radical.
3º) 3-metil-pent-2-eno
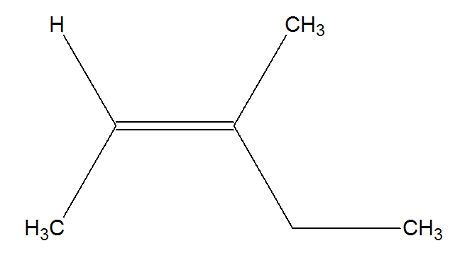
Observação: Quando tivermos no mesmo carbono como ligantes dois radicais, sempre consideraremos como ligante com maior número atômico o radical que apresentar mais carbonos.
Na estrutura, temos um metil (considera-se o carbono ligado ao carbono da dupla, Z=6) e um hidrogênio (Z=1) em um dos carbonos da dupla, e o etil (Z=6) e o metil no outro carbono (Z=6). Todavia, o etil é considerado como prioridade por ter mais carbonos. Como o plano passa entre os carbonos da dupla, o metil, que é o ligante com maior número atômico do carbono, fica à esquerda no plano inferior, e o etil, que é o ligante com maior número atômico do carbono, fica à direita no plano inferior. Como os ligantes de maior número atômico estão no mesmo plano, trata-se de um isômero geométrico Z.
4º) 2-metil-but-1-en-1-ol
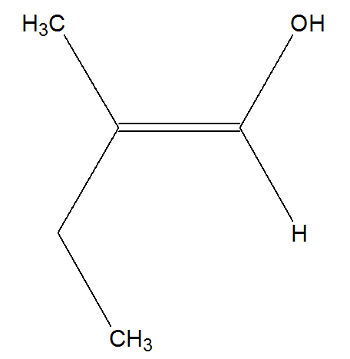
Na estrutura, temos um metil (considera-se o carbono ligado ao carbono da dupla, Z=6) e um etil (Z=6) em um dos carbonos da dupla, e o hidrogênio (Z=1) e o oxigênio (Z=8) no outro carbono. Todavia, o etil é considerado como prioridade por ter mais carbonos. Como o plano passa entre os carbonos da dupla, o etil, que é o ligante com maior número atômico do carbono, fica à esquerda no plano inferior, e o oxigênio, que é o ligante com maior número atômico do carbono, fica à direita no plano superior. Como os ligantes de maior número atômico estão no mesmo plano, trata-se de um isômero geométrico E.
5º) 1-etil-3-flúor-1,3-dimetil-ciclopentano
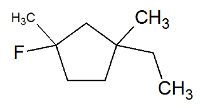
Na estrutura, temos um metil (considera-se o carbono ligado ao carbono da dupla, Z=6) e um etil (Z=6) em um dos carbonos do ciclo, e um metil (Z=6) e um flúor (Z=9) no outro carbono. Todavia, o etil é considerado como prioridade por ter mais carbonos. Como o plano passa entre os carbonos que apresentam os ligantes, o etil, que é o ligante com maior número atômico do carbono, fica à direita no plano inferior, e o flúor, que é o ligante com maior número atômico do carbono, fica à esquerda no plano inferior. Como os ligantes de maior número atômico estão no mesmo plano, trata-se de um isômero geométrico Z.
Por Me. Diogo Lopes Dias