Isomeria Plana
A isomeria plana ou constitucional subdivide-se em isomeria constitucional estática (funcional, esqueletal e posicional) e dinâmica (metameria e tautomeria).
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
Compostos isômeros são aqueles compostos orgânicos que apresentam a mesma fórmula molecular, mas se diferenciam por suas fórmulas estruturais.
Existe a isomeria plana e a espacial, sendo que enquanto a isomeria plana pode ser verificada analisando-se somente as fórmulas estruturais planas dos compostos, a isomeria espacial (estereoisomeria) leva em consideração a estrutura espacial da molécula, isto é, como seus átomos estão orientados no espaço.
Neste texto, veremos mais detalhadamente os diferentes tipos de isomeria plana, também chamada de isomeria constitucional, que são cinco: isomeria de cadeia, de função, de posição, de compensação (metameria) e tautomeria. Elas estão subdivididas da seguinte forma:
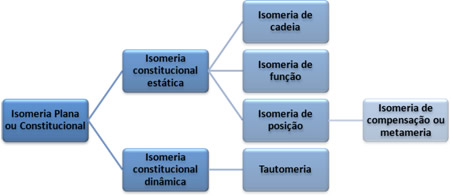
Tipos de isomeria plana ou constitucional
1. Isomeria de cadeia (esqueletal ou de núcleo): Nesse tipo de isomeria, a diferença entre os compostos está no tipo de cadeia, ou seja, eles pertencem ao mesmo grupo funcional, mas um pode ter a cadeia aberta, enquanto o outro tem a cadeia fechada, ou um tem a cadeia normal e o outro tem a cadeia ramificada, ou, ainda, um tem a cadeia homogênea e o outro tem a cadeia heterogênea.
Exemplos:
-
A seguir, temos dois compostos que são da mesma função (hidrocarbonetos), possuem a mesma fórmula molecular (C5H10), mas se diferenciam pelo fato de que um tem cadeia aberta e o outro tem cadeia fechada:
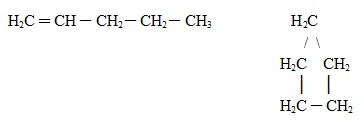
As duas estruturas abaixo são aminas e suas fórmulas moleculares são as mesmas (C2H7N), mas a diferença é que uma tem cadeia homogênea e a outra tem cadeia heterogênea:
H2C — NH — CH3 H3C — CH2 — NH2
-
Os dois compostos a seguir são ácidos carboxílicos e a fórmula molecular de ambos é C4H8O2, mas a cadeia de um é normal e a do outro é ramificada:
H3C — CH2 — CH2 — COOH H3C — CH — COOH
|
CH3
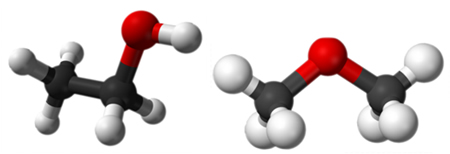
2. Isomeria de função: Os isômeros pertencem a diferentes grupos funcionais.
Um exemplo é mostrado abaixo, em que de um lado temos um ácido carboxílico e de outro temos um éster, mas ambos são isômeros porque possuem a mesma fórmula: C2H4O2.
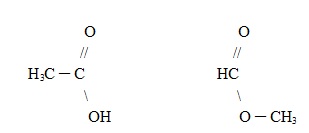
3. Isomeria de posição: Os isômeros diferenciam-se pela posição em que aparecem os seguintes itens: insaturação, grupo funcional, substituinte ou heteroátomo (Metameria).
Exemplos:
-
A fórmula dos compostos abaixo é C4H8, mas a diferença entre eles está na posição da insaturação (dupla ligação), que na estrutura da esquerda está no carbono 1, e na estrutura da direita, no carbono 2:
H2C = CH — CH2 — CH3 H3C — CH = CH — CH3
-
Os isômeros abaixo possuem a fórmula C3H8O, mas a diferença está na posição do grupo funcional OH, que no primeiro caso está no carbono 1, já no segundo caso, no carbono 2:
H2C — CH2 — CH3 H3C — CH —CH3
| |
OH OH
-
Nas estruturas a seguir (C4H6Cl2), o grupo substituinte (Cl) está em posições diferentes:
Cl — CH — CH — Cl Cl — CH — CH2
| | | |
H2C — CH2 H2C — CH — Cl
4. Metameria (isomeria de compensação): É, na realidade, um caso particular de isomeria de posição porque a diferença entre os compostos isômeros está na posição do heteroátomo.
Exemplo: Nos isômeros abaixo (C4H10O), o heteroátomo (oxigênio) está em posição diferente:
H3C — O — CH2 — CH2 — CH3 H3C — CH2 — O — CH2 — CH3
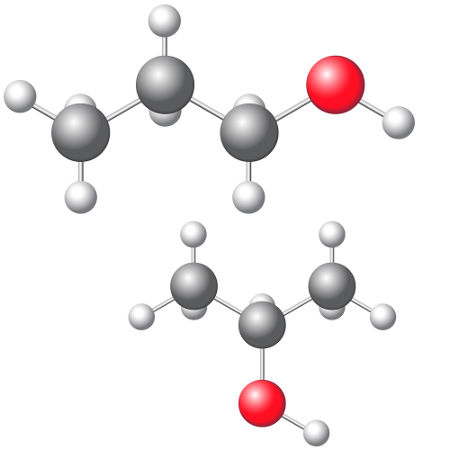
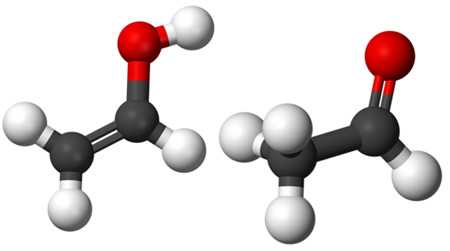
4. Tautomeria: Todos os quatro tipos de isomeria plana mencionados anteriormente são estáticos. Agora, a tautomeria é um caso particular de isomeria constitucional dinâmica, pois os seus isômeros coexistem em equilíbrio dinâmico em um sistema.
Por exemplo, em uma solução de aldeído acético (etanal), uma pequena parte transforma-se em etenol (um enol), que, por sua vez, regenera-se novamente em aldeído. Assim, há um equilíbrio químico entre esses compostos que possuem a mesma fórmula molecular – C2H4O. Dizemos que esse é um equilíbrio aldoenólico entre um aldeído e um enol:
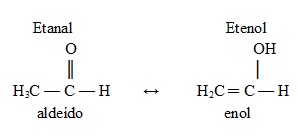
Por Jennifer Fogaça
Graduada em Química