Reações de eliminação
Reações de eliminação são reações orgânicas em que há a saída de átomos ou grupos de uma molécula.
Por Stéfano Araújo Novais

PUBLICIDADE
Reações de eliminação são reações orgânicas em que há a saída (eliminação) de átomos ou grupos de uma molécula. As reações de eliminação mais comuns são as do tipo 1,2 (ou ɑ,β), em que os átomos e grupos excluídos são oriundos de carbonos vicinais, ou seja, carbonos vizinhos que estão em posições adjacentes na cadeia. Existem dois mecanismos básicos de eliminação, E1 ou E2, embora não sejam muito citados no Ensino Médio.
As reações de eliminação ocorrem, na maioria das vezes, em haletos de alquila ou álcoois, sendo que os alcenos são os principais produtos destas. São exemplos de reações de eliminação a desidratação alcoólica e a desidroalogenação (ou dehalogenação). Sabe-se também que algumas reações de eliminação competem com reações de substituição.
Leia também: Quais são os tipos de reações orgânicas?
Resumo sobre reações de eliminação
-
Nas reações de eliminação, há sempre a saída de um átomo ou grupo de uma molécula.
-
São exemplos de reações de eliminação a desidroalogenação e a desidratação.
-
Na maioria das vezes, o produto formado em uma eliminação é um alceno.
-
Existem dois mecanismos básicos de eliminação: E1 e E2.
-
As reações de eliminação competem com as reações de substituição, ocorrendo ambas ao mesmo tempo.
Videoaula sobre reações de eliminação
Como ocorrem as reações de eliminação?
Toda reação química pode ser explicada através do que chamamos de mecanismo, ou seja, a descrição das etapas da transformação do reagente até o produto.
No caso de reações de eliminação, existem dois mecanismos básicos, os quais são chamados de E1 e E2.
-
Mecanismo E1: É uma eliminação unimolecular (intramolecular), tendo um carbocátion como intermediário. Primeiramente, há a eliminação de um íon, o qual será estabilizado por solvatação do solvente, resultando na formação do carbocátion (um carbono com carga positiva). Posteriormente, uma base de Lewis/nucleófilo (B-) ataca o hidrogênio do carbono vizinho ao carbocátion, deslocando o par de elétrons da ligação C-H para a formação da ligação dupla entre os carbonos, resultando em um alceno.
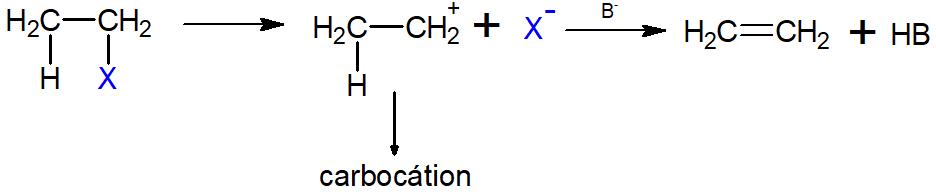
-
Mecanismo E2: É uma eliminação bimolecular, sem a presença de um grupo intermediário, em que a base de Lewis/nucleófilo (B-) ataca o hidrogênio de um carbono e este transfere seus pares de elétrons para a formação da ligação dupla imediatamente, não necessitando da formação do carbocátion.
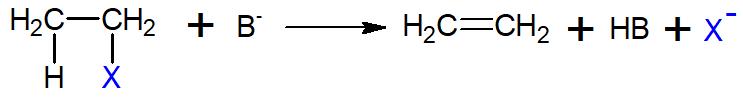
O que determina se uma reação seguirá pelo mecanismo E1 ou E2 são fatores reacionais. Por exemplo, caso haja a possibilidade de formação de um carbocátion estável e/ou se tenha uma base pouco reativa (fraca), há a tendência à eliminação E1. Ao passo que se a base de Lewis for muito reativa (forte) e o carbocátion for instável, o carbocátion não terá tempo e nem conseguirá se formar, favorecendo o mecanismo E2.
Leia também: Reações de adição — aquelas em que se adiciona um reagente a uma molécula orgânica
Tipos de reações de eliminação
-
Desidratação alcoólica: Nessa reação, o álcool é desidratado (elimina água) em meio de ácido sulfúrico, podendo se tornar um alceno (desidratação intramolecular, que ocorre a 170 °C) ou um éter (desidratação intermolecular, que ocorre a 140 °C).
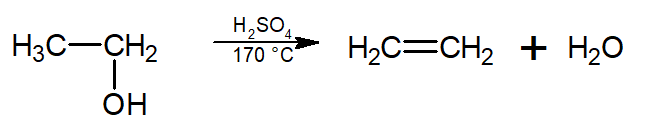
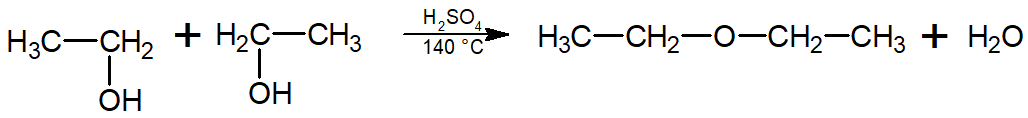
-
Desidroalogenação/dehalogenação: Nessa reação, é utilizada uma base forte, como KOH, ou um alcóxido (derivado de álcool) em meio alcoólico com aquecimento. Há a eliminação do halogênio e do hidrogênio, dando origem a um alceno. No exemplo a seguir, a base forte é um alcóxido de sódio (C2H5ONa).
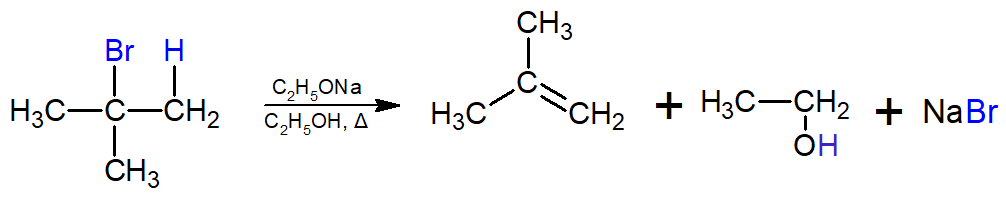
A desidroalogenação também pode ocorrer com dihaletos na presença de zinco, sejam eles vicinais ou não. No caso de dihaletos vicinais, um alceno também é formado, conforme mostra a reação a seguir.
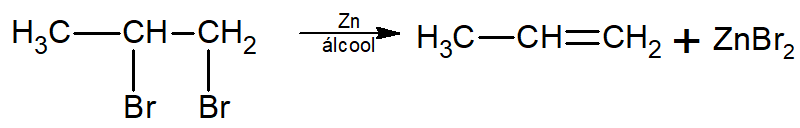
Já se os haletos não são vizinhos no composto, é formado um cicloalcano.
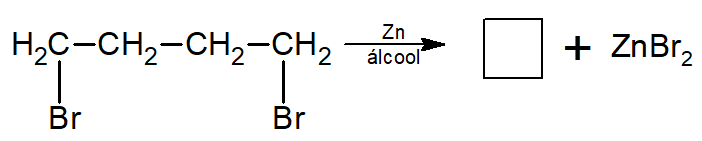
Características das reações de eliminação
A maioria das reações de eliminação tem como característica a produção de alcenos. Contudo, é possível que mais de um hidrogênio seja eliminado, podendo fazer com que um único reagente tenha a possibilidade de formação de mais de um alceno.
Deve-se atentar à Regra de Zaitsev: o alceno com ligação dupla mais substituída (ou seja, mais ramificada) é o mais estável. Essa regra é puramente empírica.
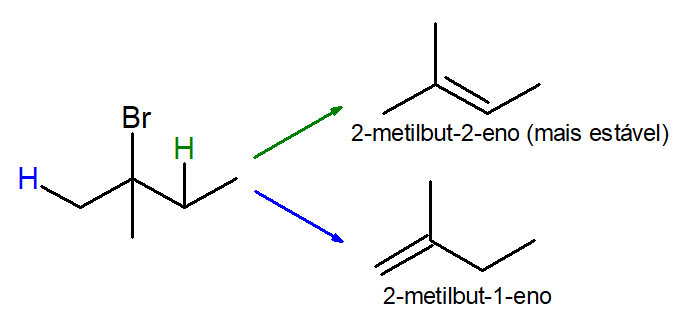
No exemplo acima, perceba que a eliminação do bromo pode ocorrer tanto com a eliminação conjunta do hidrogênio de carbono primário (azul), que resultaria no alceno 2-metilbut-1-eno, como com a eliminação conjunta do hidrogênio de carbono secundário (verde), que resultaria no alceno 2-metilbut-2-eno. Como é possível perceber, o 2-metilbut-2-eno é mais estável, uma vez que a dupla ligação é mais substituída, possuindo três radicais metil e um hidrogênio, enquanto a ligação dupla do 2-metilbut-1-eno é menos substituída, sendo este apenas dissubstituído.
Entretanto, a Regra de Zaitsev não funciona caso a base de Lewis (nucleófilo) utilizada for muito volumosa, ou seja, de tamanho grande. Quando a base é muito grande, os hidrogênios mais internos dificilmente são atacados por ela, facilitando o ataque aos hidrogênios de carbono primário, os quais estão mais expostos. Caso fosse assim no exemplo anterior, o alceno 2-metilbut-1-eno teria maior rendimento, como mostrado a seguir.
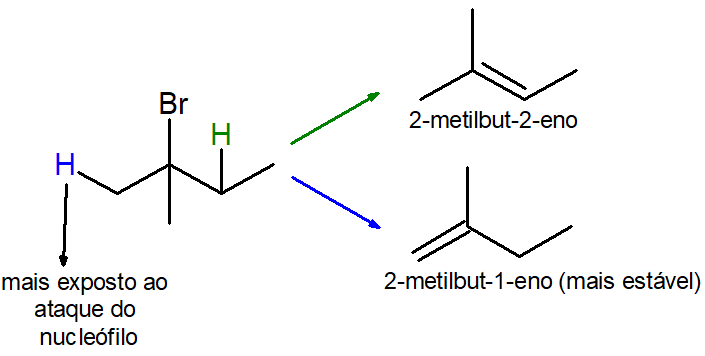
Essa alteração por conta de uma base mais volumosa é chamada de Regra de Hoffmann.
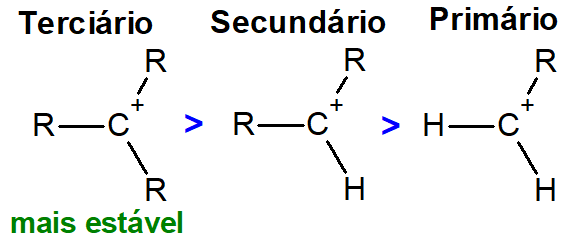
Outra característica interessante das reações de eliminação está nas reações que precisam formar o carbocátion intermediário, como na desidratação alcoólica. Como dito anteriormente, as eliminações podem ocorrer por meio da formação de um intermediário, chamado de carbocátion. Quanto mais estável for o carbocátion, mais fácil será a reação de desidratação.
Nesse ponto, os carbocátions terciários são mais estáveis que os carbocátions secundários, os quais são mais estáveis que os carbocátions primários (como mostra a imagem a seguir). Isso porque a carga positiva do carbono é melhor estabilizada pelo efeito indutivo doador de elétrons causado pelos radicais alquila ligados a ele.
Diferenças entre reações de eliminação e substituição
Tanto as reações de eliminação quanto as reações de substituição necessitam da existência de uma base de Lewis/nucleófilo. Durante a reação química, mais de um sítio positivo pode surgir e não há como controlar qual deles será atacado pelo nucleófilo. Por isso, não é difícil a ocorrência simultânea de ambas as reações em um processo.
Assim como existem os mecanismos de eliminação E1 e E2, existem os mecanismos de substituição SN1 e SN2 (substituição nucleofílica 1 e substituição nucleofílica 2). O SN1 pode ocorrer concomitantemente ao E1, enquanto o SN2 pode ocorrer concomitantemente ao E2.
No caso de reações E1 e SN1, há formação do intermediário carbocátion. Caso o nucleófilo ataque o hidrogênio do carbono vizinho ao nucleófilo, haverá uma reação de eliminação. Se o nucleófilo atacar o carbocátion, haverá uma reação de substituição.
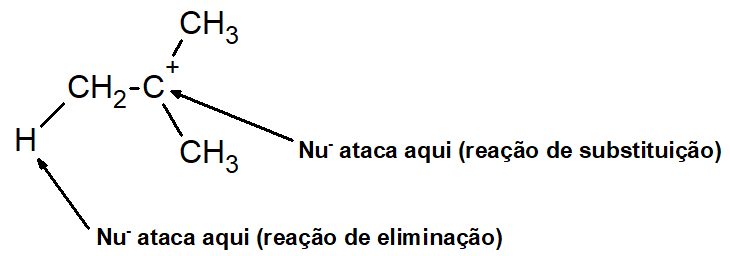
Já no caso das reações E2 e SN2, não há o carbocátion. Contudo, o carbono pode apresentar caráter mais positivo porque está ligado a um átomo ou grupo muito eletronegativo (como hidroxila ou halogênio), possibilitando o ataque nucleofílico. Se o ataque nucleofílico ocorrer nesse carbono, haverá substituição; caso ocorra no hidrogênio do carbono vizinho, haverá eliminação.
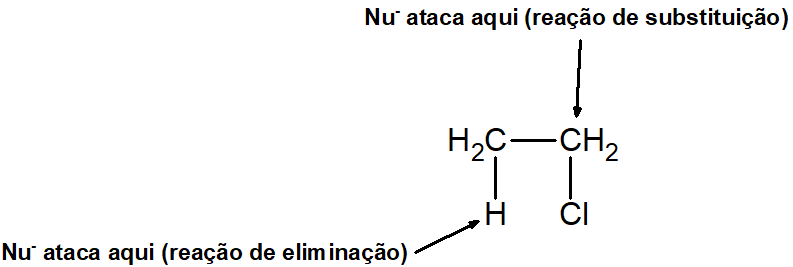
Em um exemplo prático, há a reação com o 2-bromo-propano. Caso ocorra a eliminação, o propeno será formado; caso ocorra a substituição, o álcool propan-2-ol será formado (utilizando-se uma base inorgânica forte, como KOH).
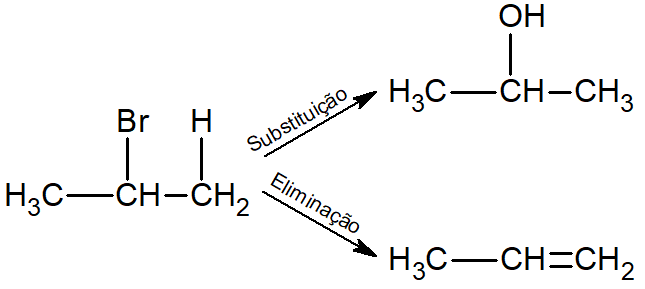
Condições para a existência de uma reação de eliminação
Como visto anteriormente, as reações de substituição e eliminação podem coexistir em um meio reacional. Isso porque as condições para sua ocorrência são muito parecidas. Por exemplo, a alta concentração de base de Lewis/nucleófilo é importante para as reações de eliminação, contudo, também é essencial para as reações de substituição. Por isso, algumas condições são fundamentais para uma boa reação de eliminação.
Por exemplo, foi dito que o mecanismo de substituição necessita do nucleófilo atacando um carbono mais eletricamente positivo. Caso existam muitos átomos de carbono (ramificações) em torno desse carbono, cria-se o que na Química se chama de “impedimento estérico”, ou seja, uma barreira de átomos que dificultará a ação do nucleófilo naquele ponto, seja por pouco espaço, seja por repulsão eletrônica. Assim, nesse tipo de cadeia, as condições para a ocorrência de uma reação de eliminação são melhores.
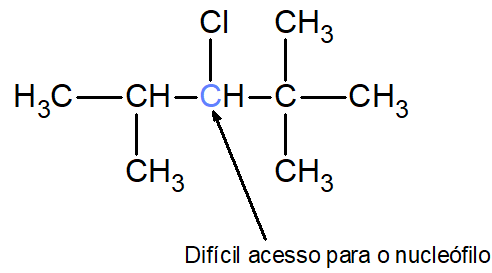
Perceba, na imagem acima, que o carbono mais positivo está rodeado por átomos de carbono, que dificultam o ataque do nucleófilo, impedindo reações de substituição.
Se a cadeia não for ramificada em torno desse carbono, uma outra condição necessária é utilizar um nucleófilo mais volumoso, que também terá dificuldade de atacar esse carbono por efeitos de impedimento estérico.
A utilização de solventes menos polares, como álcoois, e bases orgânicas, como alcóxidos, também são condições necessárias para o favorecimento de reações de eliminação.
Por fim, as reações de eliminação ocorrem com maior rendimento em temperaturas maiores, pois elas possuem energia de ativação maior que reações de substituição. O aumento da temperatura dá às moléculas maior energia cinética, fazendo com que consigam vencer a energia de ativação das reações de eliminação com mais facilidade.
Leia também: Reações de neutralização — como ocorrem?
Exercícios resolvidos sobre reações de eliminação
Questão 1
(Enem 2020) A pentano-5-lactama é uma amida cíclica que tem aplicações na síntese de fármacos e pode ser obtida pela desidratação intramolecular, entre os grupos funcionais de ácido carboxílico e amina primária, provenientes de um composto de cadeia alifática, saturada, normal e homogênea.
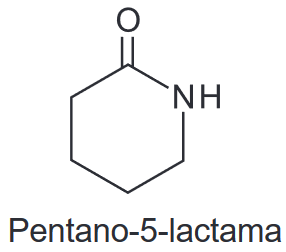
O composto que, em condições apropriadas, dá origem a essa amida cíclica é
A) CH3NHCH2CH2CH2CO2H
B) HOCH=CHCH2CH2CONH2
C) CH2(NH2)CH2CH=CHCO2H
D) CH2(NH2)CH2CH2CH2CO2H
E) CH2(NH2)CH(CH3)CH2CO2H
Resposta:
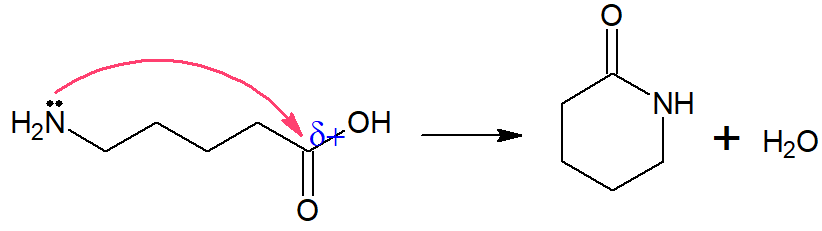
Segundo os parâmetros do enunciado, o aminoácido deve conter cinco carbonos, ser de cadeia alifática, saturada, normal e homogênea, além de possuir amina primária. Isso invalida todas as alternativas, menos a letra D, que é o gabarito, pois nessa estrutura o grupo amino (–NH2) está ligado ao carbono primário, a cadeia não possui ramificações, nem possui ligações duplas entre carbonos.
A desidratação ocorre porque o grupo amino (–NH2) tem um par de elétrons desemparelhados, capaz de fazer um ataque nucleofílico ao carbono da carboxila, mais positivo por conta dos átomos de oxigênio.
Questão 2
(FSA-SP 2008) A desidratação do etanol, dependendo das condições em que é feita, pode ser intermolecular ou intramolecular, produzindo como principais produtos, respectivamente,
A) álcool e éter.
B) éter e éster.
C) éter e hidrocarboneto.
D) álcool e hidrocarboneto.
E) éster e hidrocarboneto.
Resposta:
A desidratação alcoólica pode ocorrer de duas formas: intramolecular, em que apenas um único mol de álcool sofre desidratação, a 170 °C, e produz um alceno (hidrocarboneto); e a intermolecular, em que dois mols do álcool sofrem desidratação, a 140 °C, e produzem um éter.
Assim, a resposta certa é a da letra C.